Перейти к:
Инновационное исследование сердца плодов при монохориальном многоплодии
https://doi.org/10.69964/BMCC-2024-1-1-64-77
Аннотация
Введение. Эхокардиография плода в настоящее время является одним из основных методов пренатальной диагностики. Однако в последние годы внимание сместилось в сторону использования УЗИ для оценки функции миокарда плода.
Цель. Сравнительная оценка глобальной продольной деформации миокарда левого и правого желудочков сердца у плодов при неосложненной одноплодной беременности, у плодов из монохориальных двоен с синдромом трансфузии, селективной задержкой роста одного плода и при неосложненном течении монохориального многоплодия. Материал и методы. Проведено проспективное когортное исследование в которое включены 60 беременных пациенток: I группа — пациентки с неосложненным течением одноплодной беременности (n=25); II группа — 35 пациенток с монохориальной диамниотической двойней, беременность которых в 10 случаях осложнилась синдромом фето — фетальной трансфузии (I-III стадии по Quintero R.A.), в 10 случаях — селективной задержкой роста второго плода и в 15 случаях монохориальная двойня без осложнений. Определялись следующие параметры: глобальная продольная деформация миокарда желудочков сердец плодов методом спекл-трекинг фракции выброса (ФВ), конечно-диастолические и конечно-систолические объемы желудочков сердца.
Результаты. Установлены значимые различия глобальной продольной деформации (ГПД) ПЖ и ЛЖ между одноплодной и монохориальной многоплодной беременностью (ЛЖ плода от одноплодной беременности (- 21,2 ± 2,03) против ЛЖ обоих плодов монохориальных из диамниотических двоен — (-23,41 ± 0,25, р = 0,003), ПЖ у плода от одноплодной беременности (- 20,3 ± 2,5) против ПЖ обоих плодов МХДМ (-23,3 ± 2,5, р = 0,013). Выявлены значимые различия в глобальной продольной деформации ЛЖ и ПЖ у плодов — реципиентов до и после лазерной коагуляции плацентарных анастомозов (ЛКПА) [ЛЖ у реципиенты до ЛКПА(- 20,4 ± 2,98) против ЛЖ реципиента после ЛКПА (-24,2 ± 3,3), р = 0,018], [ПЖ у реципиенты до ЛКПА (- 20,4 ± 2,8) против ПЖ реципиента после ЛКПА (-23,7 ± 3,4, р = 0,012].
Заключение. Таким образом, не только синдром трансфузии, но и СЗРП при монохориальном многоплодии влияет на сердечную функцию близнецов, что требует дальнейшего изучения. Оценка сердечной функции плодов из монохориальных двоен с использованием эхокардиографической методики спекл-трекинг позволяет выявить ранние изменения функции миокарда плода у близнецов из монохориальных диамниотических двоен, а также осуществлять надежный мониторинг изменений сердечной функции с течением времени.
Для цитирования:
Косовцова Н.В., Маркова Т.В., Чумарная Т.В., Гусарова Е.О., Павличенко М.В., Поспелова Я.Ю., Соловьева О.Э. Инновационное исследование сердца плодов при монохориальном многоплодии. Вестник охраны материнства и младенчества. 2024;1(1):64-77. https://doi.org/10.69964/BMCC-2024-1-1-64-77
For citation:
Kosovtsova N.V., Markova T.V., Chumarnaya T.V., Gusarova E.O., Pavlichenko M.V., Pospelova Ya.Yu., Solovyova O.E. Innovative study of the fetal heart in monochorionic multiple births. Bulletin of maternal and child care. 2024;1(1):64-77. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-1-64-77
Введение
Эхокардиография плода в настоящее время является одним из основных методов пренатальной диагностики. В Российской Федерации ультразвуковое исследование (УЗИ) сердца плода является частью программы скрининга аномалий плода, при этом при подозрении на какие-либо аномалии проводится более подробная эхокардиография плода в специализированных центрах. При первоначальном внедрении эхокардиография плода была направлена на выявление врожденных пороков сердца (ВПС). Однако в последние годы внимание сместилось в сторону использования УЗИ для оценки функции миокарда плода [1]. Это, безусловно, имеет значение при оценке первичного заболевания миокарда у плода, но, кроме того, учитывая центральную роль сердца в адаптивном ответе плода на некоторые патологические процессы, это может иметь значение при лечении и прогнозировании других неинфекционных заболеваний сердца, такие как синдром фето-фетальной трансфузии (СФФТ) у монохориальных диамниотических двоен (МХДА) [2]. Субъективная оценка сократительной способности миокарда еще недавно была наиболее часто используемым методом оценки сердечной функции в период внутриутробного развития. В настоящее время разработаны методы для ее точного количественного определения. Применение этих методов позволяет осуществить выявление ранних изменений, до того как субъективная оценка сможет определить ухудшение функции или развитие водянки, а также надежный мониторинг изменений сердечной функции с течением времени.
Для оценки сердечной функции плода можно использовать множество различных эхокардиографических методов, включая М-режим, импульсную допплерографию и методы тканевой допплерографии [3-5]. Как правило, функциональная оценка миокарда плода затруднена, так как сердце плода представляет собой малую структуру внутри небольшого, подвижного объекта.
Положение плода непредсказуемо, что может затруднить получение изображения, и это может усугубляться материнским телосложением. Еще одна сложность заключается в том, что плод одновременно растет и созревает и нормальные референсные диапазоны деформации миокарда могут нуждаться в корректировке с учетом гестационного возраста или размера сердца плода. Оценка сердца плода должна быть достаточно чувствительной, чтобы выявить дисфункцию миокарда в доклиническом состоянии, до развития выраженной недостаточности [6-8].
Дальнейшие трудности в оценке сердечной функции плода возникают из-за различий в том, как миокард плода реагирует на гемодинамические изменения. Кардиомиоциты плода завершают окончательную дифференцировку только ближе к сроку родов. Это означает, что сердце плода может реагировать на изменение давления и объема пролиферацией и гипертрофией. Эти реакции менее понятны, чем в постнатальной жизни, что усложняет оценку функции миокарда до рождения [9-11].
В данной статье представлены пилотные данные оценки деформации миокарда ЛЖ и ПЖ сердца плодов из монохориальных двоен с использованием эхокардиографической методики спекл-трекинг (СПТ). Пренатальное использование СПТ у близнецов с монохориальной плацентацией представляет несомненный интерес. По данной теме в мировой литературе существуют единичные публикации.
Данная методика является относительно новой эхокардиографической техникой, впервые описанной у взрослых в 2004 г [12]. Это полуавтоматический процесс, выполняемый в автономном режиме на ранее полученных двухмерных эхокардиографических изображениях в В-режиме с использованием уникального программного обеспечения.
СПТ соответствует всем требованиям, предъявляемым к методам эхокардиографии, а именно:
- возможность в одну манипуляцию измерить размеры, форму, сократимость желудочков сердца
- при исследовании не зависеть от угла сканирования, т.е. положения плода
- представлять результаты с использованием переменных независящих от срока и биометрических показателей плода
- всё исследование не должно занимать 5 минут.
- Сокращения сердца в течение внутриутробной жизни плода, и оценка деформации дает новое представление о механике миокарда на ранних этапах развития человека. [12]
Цель исследования. Провести сравнительную оценку глобальной продольной деформации миокарда левого и правого желудочков сердца у плодов при неосложненной одноплодной беременности, у плодов из монохориальных двоен с синдромом трансфузии, селективной задержкой роста одного плода из двойни и при неосложненном течении монохориального многоплодия.
Материал и методы
Проведено проспективное когортное исследование на базе ФГБУ «НИИ ОММ» МЗ РФ, в исследование были включены 60 беременных пациенток.
I группу составили 25 пациенток с неосложненным течением одноплодной беременности (n=25).
II группу представили 35 пациенток с монохориальной диамниотической двойней: беременность которых в 10 случаях осложнилась синдромом фето–фетальной трансфузии (I-III стадии по Quintero R.A.) до и после лазерной коагуляции плацентарных анастомозов (ЛКПА); в 10 случаях — селективной задержкой роста второго плода; и в 15 случаях монохориальная двойня вынашивалась без осложнений. Селективная задержка роста одного плода определялась как снижение предполагаемой массы одного из плодов менее 10-ого перцентиля.
Дизайн исследования представлен на рисунке 1.
В исследовании определялись следующие параметры: глобальная продольная деформация миокарда желудочков сердец плодов методом СПТ, фракции выброса, конечно-диастолические и конечно-систолические объемы желудочков сердца.
Срок беременности пациенток I и II группе на момент поступления в стационар составил 25,0 (20,0;28,0) недель беременности. Соматический статус пациенток I и II группы достоверно не отличался (p>0,05, Таблица 1). При анализе акушерско–гинекологического статуса пациенток I и II группы достоверных отличий не получено (p>0,05, Таблица 2).
Критерии включения во II группу:
- МХДА двойни с неосложненным течением беременности,
- МХДА двойни с СФФТ
- МХДА двойни с СЗРП.
Критерии не включения во II группу:
- Дихориальные диамниотические двойни.
- Супермногоплодная беременность.
- Декомпенсированная экстрагенитальная патология.
- Тяжелая преэклампсия, эклампсия, НЕLLP — синдром.
- Миома матки больших размеров и узловая форма эндометриоза.
- Инфекция В-20, гепатит В, гепатит С.
- Беременности с подтвержденными врожденными пороками развития одного или обоих плодов.
Перед началом исследования все специалисты по УЗИ были обучены оптимизации четырехкамерных кардиологических клипов для получения изображений с хорошим контрастом и максимально высокой частотой кадров (80-100 Гц). Большинство сканирований было выполнено с использованием ультразвуковых аппаратов Canon «Aplio i700» с использованием конвексного датчика GE-4D и Philips EPIQ Elite с использованием конвексного датчика C9-2. Все данные хранились в формате DICOM. Все клипы DICOM были обезличены, импортированы в программное обеспечение для отслеживания спеклов (QLab, TomTec) для автономного анализа. Пакетное измерение глобальной продольной деформации ЛЖ и ПЖ было выполнено двумя исследователями, которые не знали о исходе беременности.
Глобальная пиковая деформация миокарда в систолу желудочка определяется программным обеспечением как отрицательное процентное значение. Мы использовали термины «снижение деформации» для менее отрицательных значений и «увеличение деформации» для более отрицательных значений (Рисунок 2, 3).
Для оценки деформации использовалась апикальная четырехкамерная проекция. Сканы были собраны при средней частоте кадров 99 (диапазон 36–200) Гц. Оценивались: продольная деформация левого и правого желудочка конечный диастолический объем и конечный систолический объем у 35 пар плодов из монохориальных диамниотических (МХДА) двоен и 25 плодов при одноплодной беременности.
Исследование было одобрено локальным этическим комитетом ФГБУ «НИИ ОММ» МЗ РФ, информированное согласие на участие в исследование пациенток получено.
Статистический анализ проведен с помощью программы IBM SPSS 23.0 (USA). Для показателей, характеризующих качественные признаки, указано абсолютное значение и относительная величина в процентах, проверка статистических гипотез осуществлялась с использованием критерия хи-квадрат (χ2) и точного критерия Фишера (в случае значений ожидаемых частот меньше 5). Для парных сравнений связанных качественных характеристик использовался критерий Мак-Немара, при множественном сравнении делалась поправка на множественные сравнения.
Для количественных переменных рассчитывались средние арифметические значения и стандартные отклонения (m±sd) в случае подтверждения нормальности распределения признака, или медиана и (25 процентиль; 75 процентиль) в противном случае. Проверка нормального распределения признаков проводилась с помощью критерия Шапиро-Уилка.
Для количественных величин, имеющих нормальное распределение, сравнение в двух независимых группах проводилось с помощью Т-критерия Стьюдента. Сравнения трех и более независимых групп проводили с помощью однофакторного дисперсионного анализа. Для дисперсионного анализа проводилась проверка равенства дисперсий с помощью критерия Левене. При обнаружении статистически значимых межгрупповых различий осуществлялось попарное апостериорные сравнение групп с помощью критерия Тьюки. Силу и направление связи измеряли с помощью коэффициента корреляции Пирсона (r). Корреляционные зависимости были распределены по силе связи: сильная (r = 1,0–0,8), умеренная (r = 0,79–0,6) и слабая (r = 0,59–0,4).
Для количественных величин, не имеющих нормального распределения, сравнение двух независимых групп проводилось с помощью критерия Манна–Уитни. Межгрупповые различия между тремя и более группами оценивались с помощью Краскела-Уоллиса. При обнаружении статистически значимых межгрупповых различий осуществлялось попарное апостериорные сравнение групп с U-критерий Вилкоксона-Манна-Уитни с поправкой на множественные сравнения. Силу и направление связи измеряли с помощью коэффициента ранговой корреляции Спирмена. Коэффициент, равный 0–0,29 отражал слабую связь между изучаемыми признаками, 0,3–0,69 — среднюю, 0,7–1,0 — сильную связь.
Парные сравнения двух связных выборок проводилось с помощью критерия Вилкоксона.
Критический уровень статистической значимости был принят равным 0,05.
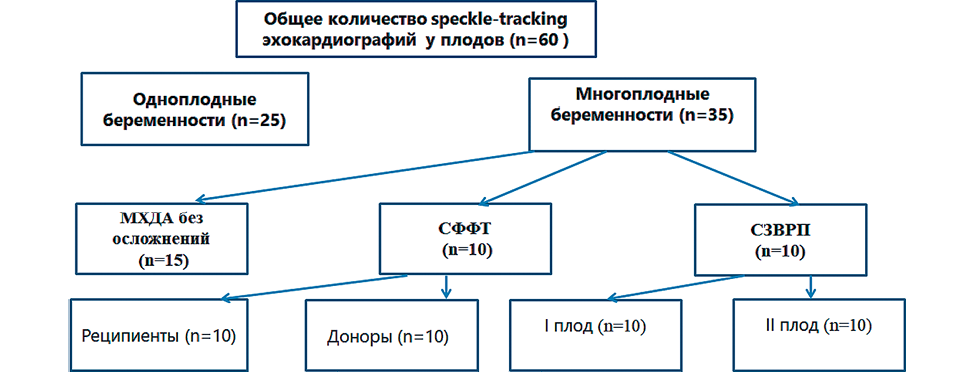
Рисунок 1. Дизайн исследования
Figure 1. Study design
Таблица 1. Соматический статус пациенток групп с одноплодной беременностью и МХДА двойнями
Table 1. Somatic status of patients in the groups with singleton pregnancy and monochorionic diamniotic twins
Класс заболевания по МКБ | Группа 1 (n=25) | Группа 2 (n=35) | Уровень значимости (p) | ||
Абс. | % | Абс. | % | ||
Класс IV. Болезни эндокринной системы, расстройства питания и нарушения обмена веществ | 3 | 12,0 | 4 | 11.4 | ОШ = 1,06 (0,21 до 5,2) |
Класс IX. Болезни системы кровообращения | 3 | 12,0 | 5 | 14,2 | ОШ = 0,82 (0,18 до 3,79) |
Класс XI. Болезни органов пищеварения | 6 | 24,0 | 7 | 20,0 | ОШ = 1,26 (0,37 до 4,35) |
Класс XIV. Болезни мочеполовой системы | 2 | 8,0 | 4 | 11.4 | ОШ = 0,93 (0,14 до 6) |
Класс X. Болезни органов дыхания | 7 | 28,0 | 8 | 22,8 | ОШ = 1,31 (0,4 до 4,26) |
Таблица 2. Акушерско-гинекологический анамнез групп с одноплодной беременностью и МХДА двойнями
Table 2. Obstetric and gynecological anamnesis of groups with singleton pregnancy and monochorionic diamniotic twins
Акушерско-гинекологический анамнез | Группа I (n=25) | Группа II (n=35) | Достоверность различий | ||
% | Абс. | % | Абс. | ||
ХВМИ | 8,0 | 2 | 8,5 | 3 | ОШ= 0,93 (0,14 до 6) |
ЭКО | 12,0 | 3 | 11,4 | 4 | ОШ = 1,06 (0,21 до 5,2) |
Медицинские аборты в анамнезе | 16,0 | 4 | 14,2 | 5 | ОШ = 1,14 (0,27 до 4,77) |
Первобеременные | 20,0 | 5 | 17,1 | 6 | ОШ = 1,21 (0,32 до 4,51) |
Повторно беременные, первородящие | 4,0 | 1 | 8,5 | 3 | ОШ = 0,44 (0,04 до 4,54) |
Повторнородящие | 76,0 | 19 | 74,2 | 26 | ОШ = 1,1 (0,33 до 3,6) |
Невынашивание в анамнезе | 16,0 | 4 | 17,1 | 6 | ОШ = 0,92 (0,23 до 3,67) |
Бесплодие в анамнезе | 20,0 | 5 | 20,0 | 7 | ОШ = 1 (0,28 до 3,61) |
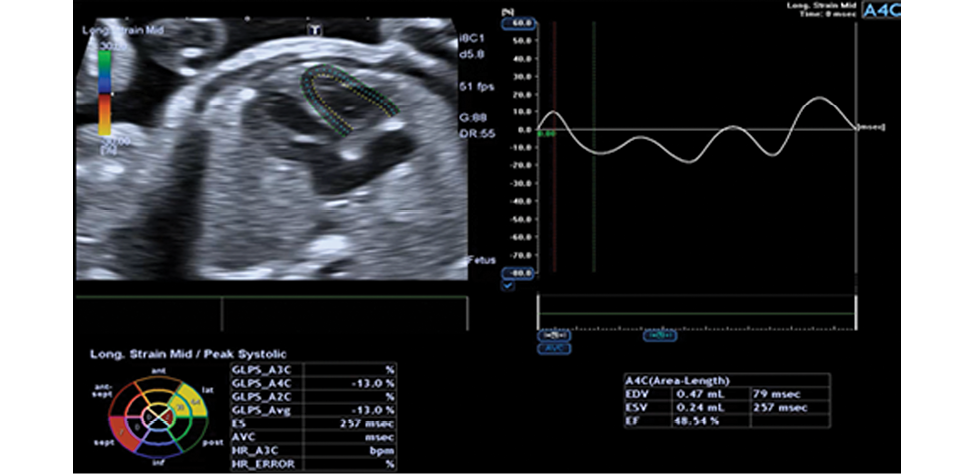
Рисунок 2. Оценка продольной деформации ПЖ плода методом СПТ
Figure 2. Assessment of longitudinal deformation of the fetal RV using speckle tracking method
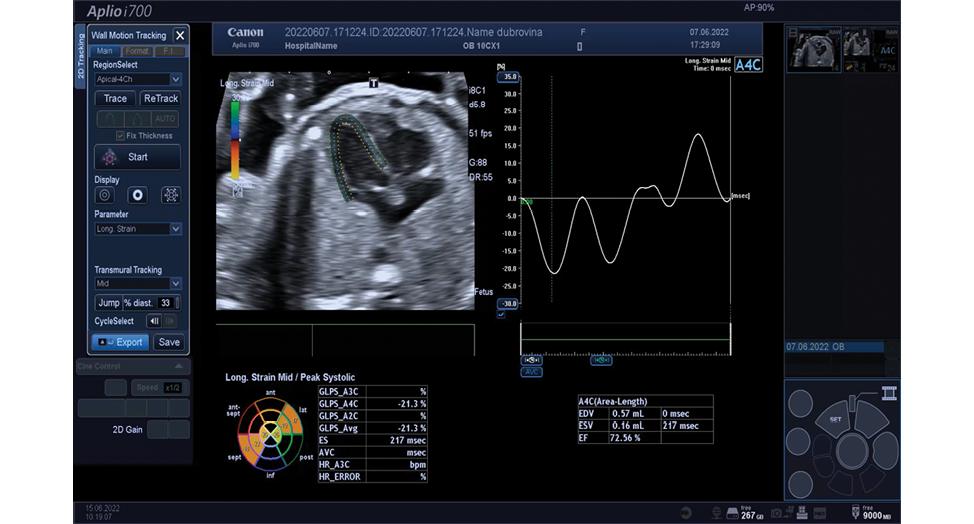
Рисунок 3. Оценка продольной деформации ЛЖ плода методом СПТ
Figure 3. Assessment of longitudinal deformation of the fetal LV using speckle tracking method
Результаты
В исследовании проанализированы данные 95 плодов у 60 беременных пациенток. 70 плодов были из монохориальных двоен и в процессе наблюдения делились: на группу плодов с СФФТ, СЗРП и группу плодов с неосложненным течением беременности. В таблицах 3 и 4 приведены сводные данные по продольной деформации левого (ЛЖ) и правого желудочка (ПЖ), конечно-диастолическому объему (КДО), конечно-систолическому объему (КСО) и фракции выброса в исследуемых группах.
Установлены значимые различия глобальной продольной деформации (ГПД) ПЖ и ЛЖ между одноплодной и монохориальной многоплодной беременностью [ЛЖ у одноплодной беременности (- 21,2 ± 2,03) против ЛЖ обоих плодов МХДА (-23,41 ± 0,25, р = 0,003], [ПЖ у одноплодной беременности (- 20,3 ± 2,5) против ПЖ обоих плодов МХДА (-23,3 ± 2,5, р = 0,013]. Усиление глобальной продольной деформации миокарда при монохориальном многоплодии наглядно иллюстрирует изменение гемодинамики у близнецов даже в ситуациях с неосложнённым течением монохориального многоплодия (Рисунок 4, 5).
Выявлены значимые различия в глобальной продольной деформации ЛЖ и ПЖ у плодов — реципиентов до и после лазерной коагуляции плацентарных анастомозов [ЛЖ у реципиенты до ЛКПА(- 20,4 ± 2,98) против ЛЖ реципиента после ЛКПА (-24,2 ± 3,3), р = 0,018], [ПЖ у реципиенты до ЛКПА (- 20,4 ± 2,8) против ПЖ реципиента после ЛКПА (-23,7 ± 3,4, р = 0,012]. Наблюдалось усиление глобальной продольной деформации миокарда ЛЖ и ПЖ после коррекции СФФТ, что характеризует положительное влияние внутриутробной коррекции СФФТ на гемодинамику плодов — реципиентов.
В ходе исследования получены значимые различия между донором и реципиентом в разнице (∆) г ЛЖ и ПЖ до и после ЛКПА [∆ ГПД ЛЖ у реципиента 4,75 ± 3,91 против ∆ ГПД ЛЖ донора 0,19 ± 3,94, р =0,049, [∆ ГПД ПЖ у реципиента 4,34 ± 2,42 против ∆ ГПД ПЖ донора -0,78± 4,09, р =0,027], что наглядно демонстрирует улучшение гемодинамических показателей в большей степени у реципиентов после коагуляции плацентарных анастомозов (Рисунок 6, 7).
В результате исследования найдена корреляционная зависимость между глобальной продольной деформацией ЛЖ плода реципиента и степенью СФФТ (R Спирмана=0,62, р =0,050), она уменьшается, что доказывает значительное влияние степени СФФТ на внутриутробное состояние сердечно-сосудистой системы плодов, что доказано многими предыдущими исследованиями (Рисунок 8).
В результате данного исследования получены значимые различия в разнице глобальной продольной деформации ЛЖ и ПЖ при сравнении двоен без СЗРП и с СЗРП [∆ ГПД ЛЖ МХДА с нормальной массой плодов для гестационного возраста (-0.18±0.91) против ∆ ГПД ЛЖ и МХДА с СЗРП 4.59±3.73, р =0,006], таким образом, не только СФФТ оказывает влияние на сердечно-сосудистую систему близнецов. У плодов с селективной задержкой роста наблюдаются особенности функции миокарда. Эти плоды имели более высокие значения глобальной деформации миокарда, чем контрольные значения.
Таким образом, не только СФФТ, но и СЗРП при монохориальном многоплодии влияет на сердечную функцию близнецов, что требует дальнейшего изучения.
Таблица 3. Сравнение продольной деформации левого и правого желудочка, конечно-диастолического и конечно-систолического объема и фракции выброса между группами с одноплодной беременностью и МХДА двойнями.
Table 3. Comparison of longitudinal strain of the left and right ventricle, end-diastolic and end-systolic volume and ejection fraction between groups with singleton pregnancy and monochorionic diamniotic twins.
Характеристики | Одноплодные беременности | МХДА двойни (плоды n=70) | Уровень значимости (p) |
ГПД ЛЖ, % | -21±2 | -24±3 | 0.025 |
ГПД ПЖ, % | -20±3 | -24±3 | 0.012 |
ФВ ЛЖ, % | 74±3 | 72±5 | 0.291 |
КДО ЛЖ, мл | 0.40±0.33 | 0.47±0.35 | 0.609 |
КСО ЛЖ, мл | 1.14±0.58 | 1.02±0.47 | 0.513 |
ФВ ПЖ, % | 74±2 | 66±13 | <0.001 |
КДО ПЖ, мл | 0.51±0.24 | 0.54±0.43 | 0.782 |
КСО ПЖ, мл | 0.98±0.38 | 1.03±0.58 | 0.784 |
Таблица 4. Сравнение продольной деформации левого и правого желудочка, конечно-диастолического и конечно-систолического объема и фракции выброса между группами с СФФТ, СЗРП и группы с неосложненным течением беременности
Table 4. Comparison of longitudinal strain of the left and right ventricle, end-diastolic and end-systolic volume and ejection fraction between the groups with transfusion syndrome, selective growth retardation and in uncomplicated monochorionic multiple pregnancy
Показатели | МХДА без осложнений (плоды n=30) | СФФТ реципиенты (плоды n=20) | СФФТ | СЗРП I плод — больший (плоды n=20) | СЗРП II плод- меньший (плоды n=20) |
ГПД ЛЖ, % | -24±2 | -20±3*^ | -27±3^ | -25±2 | -26±0 |
ГПД ПЖ, % | -23±2 | -20±3^ | -27±3*^ | -25±2 | -25±2 |
ФВ ЛЖ, % | 70±6 | 71±5 | 74±4 | 77±2 | 71±2 |
КДО ЛЖ, мл | 0.6±0.4 | 0.3±0.2 | 0.3±0.2 | 0.2±0.2 | 0.4±0.4 |
КСО ЛЖ, мл | 1.2±0.6 | 0.8±0.3 | 0.9±0.3 | 0.6±0.3 | 0.9±0.3 |
ФВ ПЖ, % | 64±12 | 65±17 | 68±10 | 69±8 | 61±17 |
КДО ПЖ, мл | 0.7±0.5 | 0.3±0.3 | 0.3±0.2 | 0.9±0.4 | 0.6±0.6 |
КСО ПЖ, мл | 1.3±0.7 | 0.7±0.3 | 0.7±0.4 | 1.3±0.1 | 1.0±0.6 |
* — p<0.05 при сравнении с группой МХДА без осложнений
^ — p<0.05 при сравнении донор и реципиент
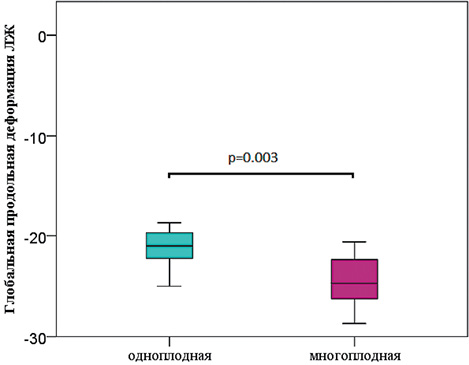
Рисунок 4. Глобальная продольная деформация ЛЖ плодов при одноплодной беременности и при монохориальном многоплодии
Figure 4. Global longitudinal deformation of the LV of fetuses in singleton pregnancies and monochorionic multiple pregnancies
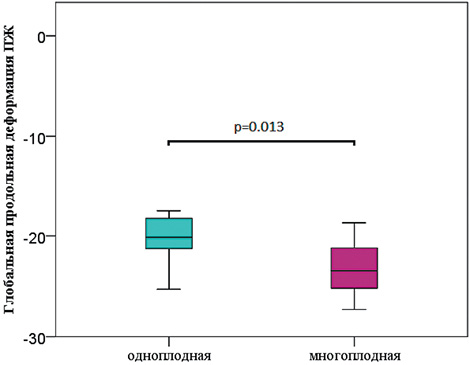
Рисунок 5. Глобальная продольная деформация ПЖ плодов при одноплодной беременности и у МХДА двойни
Figure 5. Global longitudinal deformation of the RV of fetuses in singleton pregnancies and monochorionic multiple pregnancies
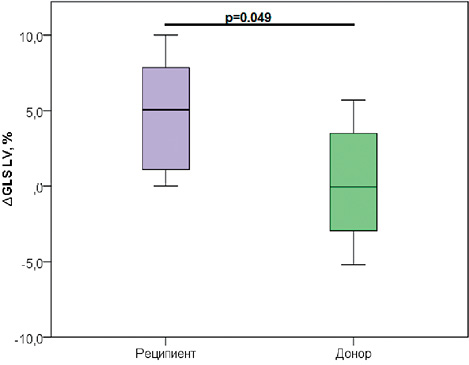
Рисунок 6. Изменение глобальной продольной деформации ЛЖ у донора и реципиента до и после ЛКПА
Figure 6. Changes in global longitudinal strain of the LV in the donor and recipient before and after laser coagulation of placental anastomoses
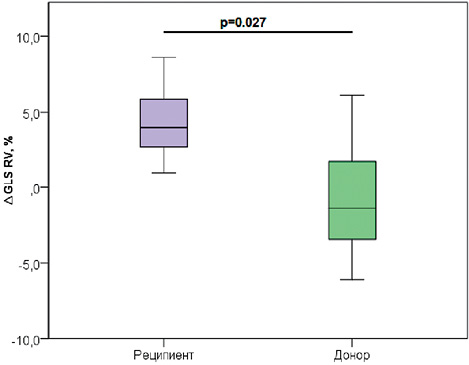
Рисунок 7. Изменение глобальной продольной деформации ПЖ у донора и реципиента до и после ЛКПА
Figure 7. Changes in global longitudinal strain of the RV in the donor and recipient before and after laser coagulation of placental anastomoses
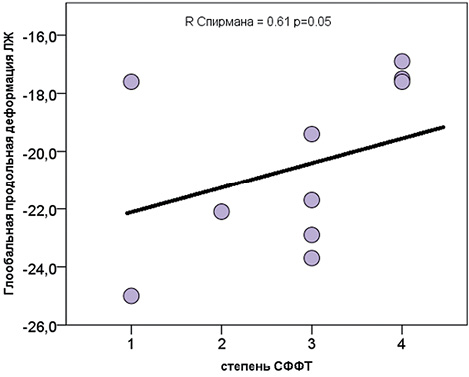
Рисунок 8. Зависимость ГПД ЛЖ плодов от степени СФФТ
Figure 8. Dependence of fetal LV global longitudinal strain on the degree of feto-fetal transfusion syndrome
Обсуждение
В ходе нашего исследования установлены значимые различия в ГПД ПЖ и ЛЖ между одноплодной и монохориальной многоплодной беременностью. Выявлены значимые различия в глобальной продольной деформации ЛЖ и ПЖ у плодов — реципиентов до и после лазерной коагуляции плацентарных анастомозов (ЛКПА). Обнаружено увеличение глобальной продольной деформации миокарда у плодов после ЛКПА по сравнению с ее значениями до операции, что свидетельствует о сложном процессе восстановления функции миокарда после перенесенного СФФТ. В ходе исследования получены значимые различия в разнице (∆) глобальной продольной деформации ЛЖ и ПЖ между донором и реципиентом до и после ЛКПА. Найдена корреляционная зависимость между глобальной продольной деформацией ЛЖ и степенью СФФТ. В результате данного исследования получены значимые различия в разнице глобальной продольной деформации ЛЖ и ПЖ при сравнении двоен без СЗРП и с СЗРП.
При изучении литературных источников по данному вопросу, мы столкнулись с ограниченным количеством исследований по применению СПТ для изучения функции миокарда при монохориальном многоплодии и зачастую с противоречивыми данными разных авторов [13][14].
Особенности сердечно-сосудистой системы при СФФТ был изучен в двух исследованиях с использованием СПТ [13][14]. В одном исследовании, посвященном только плоду-реципиенту, было обнаружено значительное снижение глобальной функции миокарда ПЖ по сравнению с контрольной группой (0,75+/-0,34 против 1,00+/-0,37 кратного медианы, p=0,04). [13]. Аналогичные данные были зарегистрированы и в нашем исследовании.
Другое исследование показало, что у доноров напряжение ЛЖ было увеличено, в то время как напряжение ПЖ было снижено, у реципиентов напряжение обоих желудочков было снижено [14].
Исследование с использованием СПТ при СФФТ и СЗРП у монохориальных двоен опубликовано в 2019 году [15]. В этом слепом перспективном исследовании был сделан вывод, что технические ограничения измерения деформации ставят под сомнение клиническую целесообразность этого метода в ранней диагностике и лечении СФФТ в настоящее время [15].
В нашем пилотном исследовании мы подтвердили изменения глобальной продольной деформации миокарда желудочков сердца плодов на фоне СФФТ и ее зависимость от степени выраженности синдрома, а также впервые получены значимые различия в разнице глобальной продольной деформации ЛЖ и ПЖ при сравнении двоен без СЗРП и с СЗРП.
Заключение
При монохориальном многоплодии без осложненного течения беременности наблюдается увеличение глобальной продольной деформации миокарда плодов по сравнению с одноплодной беременностью, что объясняется функционированием анастомозов и их влиянием на гемодинамику близнецов. При СФФТ с увеличением степени синдрома у глобальная продольная деформация ЛЖ уменьшалась, что проявляется формированием кардиомиопатии и сферизации сердца плода.
В результате проведения ЛКПА гемодинамика у плода — реципиента резко улучшается, что отличает его от плода-донора.
Зарегистрированы отличия гемодинамики при сравнении двоен без СЗРП и с СЗРП, что в дальнейшем может быть критерием выбора метода внутриутробной коррекции.
В нашем исследовании мы пришли к выводу, что бивентрикулярный анализ спекл-трекинга и количественная оценка функции миокарда у монохориальных близнецов возможны. Дальнейшая проспективная проверка наших выводов и выявление прогностических показателей гемодинамики позволят определить результат оперативного лечения осложнений монохориального многоплодия и определить степень повреждения миокарда у плодов из МХДА двоен.
Ключевые моменты
- При синдроме фето-фетальной трансфузии с увеличением степени синдрома у плодов глобальная продольная деформация левого желудочка уменьшается что проявляется формированием кардиомиопатии.
- В результате проведения лазерной коагуляции плацентарных анастомозов гемодинамика у плода — реципиента резко улучшается.
- Использованием пренатальной эхокардиографической методикиспекл-трекинг позволят определить результат оперативного лечения осложнений монохориального многоплодия и определить степень повреждения миокарда у плодов из монохориальных диамниотических двоен.
Список сокращений
ВПС — врожденные пороки сердца, ГПД — глобальной продольной деформации, КДОконечный диастолический объем, КСО конечный систолический объем, ЛЖ — левый желудочек, ЛКПА- лазерная коагуляция плацентарных анастомозов, МХДА — монохориальные диамниотические двойни, ПЖ — правый желудочек, СЗРП — синдром замедления роста плода, СПТ — метод спекл-трекинг, СФФТ — синдром фето-фетальной трансфузии, УЗИ — ультразвуковое исследование, ФВ — фракции выброса, ХВМИ -хроническая внутриматочная инфекция, ЭКО- экстракорпоральное оплодотворение.
Список литературы
1. Crispi F, Sepulveda-Swatson E, Cruz-Lemini M, et al. Feasibility and reproducibility of a standard protocol for 2D speckle tracking and tissue doppler analysis of fetal heart strain and strain rate. Fetal Diagnostics. 2012; 32: 96–108. https://doi.org/10.1159/000337329
2. Crispi F, Gratakos E. Fetal cardiac function: technical aspects and potential research and clinical applications. Fetal Diagnostics. 2012; 32:47–64. https://doi.org/10.1159/000338003
3. Godfrey ME, Messing B, Valsky D, et al. Fetal cardiac function: M-mode and correlation of 4D spatiotemporal imaging. Fetal Diagnostics. 2012; 32:17-21. https://doi.org/10.1159/000335357
4. Godfrey ME, Messing B, Cohen SM, et al. Functional assessment of the fetal heart: a review. Ultrasound Obstet Gynecol. 2012; 39:131–144. https://doi.org/10.1002/uog.9064
5. Hernandez-Andrade E, Benavidez-Serralde JA, Cruz-Martinez R, et al. Evaluation of standard fetal heart function doppler parameters: E/A ratio, outflow tracts, and myocardial performance index. Fetal Diagnostics. 2012; 32:22–29. https://doi.org/10.1159/000330792
6. Shah AM, Solomon SD. Visualization of myocardial deformity: state of the art and perspectives. Circulation. 2012; 125 : 244–248 . https://doi.org/10.1161/CIRCULATIONAHA.111.086348
7. Blessberger H, Binder T. Non-invasive imaging: two-dimensional speckle-tracking echocardiography: fundamentals. Heart. 2010; 96:716–722. https://doi.org/10.1136/hrt.2007.141002
8. D’Huge J, Heimdal A, Jamal F, et al. Regional strain and strain rate measurements with cardiac ultrasound: principles, implementation, and limitations. Eur J Echocardiog. 2000; 1 : 154–170. https://doi.org/10.1053/euje.2000.0031
9. Mirea O, Duchenne J, Voigt Y. Recent advances in echocardiography: visualization of strain and strain rate. F1000Res. 2016; 5:787. https://doi.org/10.12688/f1000research.7228.1
10. Germanakis I, Gardiner H. Assessing fetal myocardial deformity using speckle tracking techniques. Fetal Diagnostics. 2012; 32:39-46. https://doi.org/10.1159/000330378
11. Bijnens B, Cikes M, Butakoff C, et al. Myocardial movement and deformation: what does it tell us and how does it relate to function? Fetal Diagnostics. 2012; 32:5-16. https://doi.org/10.1159/000335649
12. Leitman M, Lysyansky P, Sidenko S, et al. 2D strain is a new software for real-time quantitative echocardiographic assessment of myocardial function. J Am Soc Echocardiog. 2004; 17:1021–1029. https://doi.org/10.1016/j.echo.2004.06.019
13. Rychik J, Zeng S, Bebbington M, et al. Speckle-tracking imaging of myocardial deformity in intertwin transfusion syndrome: differences in deformity and strain rate between donor and recipient twins. Fetal Diagnostics. 2012; 32:131–137. https://doi.org/10.1159/000335403
14. Van Migem T, Juuska S, DeConinck P, et al. Prospective evaluation of fetal cardiac function with speckle tracking in healthy fetuses and recipient fetuses with twin-to-twin transfusion syndrome. J Am Soc Echocardiog. 2010; 23:301-308. https://doi.org/10.1016/j.echo.2009.12.024
15. Wohlmuth C, Agarwal1 A, Stevens1 B, et al. Gardiner fetal ventricular strain in uncomplicated and selective growth-restricted monochorionic diamniotic twin pregnancies and cardiovascular response in pre-twin–twin transfusion syndrome. Ultrasound Obstet Gynecol. 2020; 56: 694–704. https://doi.org/10.1002/uog.21911
Об авторах
Н. В. КосовцоваРоссия
Косовцова Наталья Владимировна — доктор медицинских наук, руководитель отдела биофизических методов исследования, врач высшей категории ФГБУ «Уральский НИИ ОММ» МЗ РФ; профессор ФГБОУ ВО «УрФУ».
ул. Репина, д. 1, Екатеринбург, 620028; ул. Мира, д. 19, Екатеринбург, 620002
Телефон: +7(912)26-59-169
Т. В. Маркова
Россия
Маркова Татьяна Владимировна — кандидат медицинских наук, ведущий научный сотрудник.
ул. Фучика, 5-1, Екатеринбург
Т. В. Чумарная
Россия
Чумарная Татьяна Владиславовна — кандидат биологических наук, старший научный сотрудник лаборатории математической физиологии, ФГБУН ИИФ УрО РАН, ФГБОУ ВО «УрФУ».
ул. Мира, д. 19, Екатеринбург, 620002; ул. Первомайская, д. 106, Екатеринбург, 620078
Е. О. Гусарова
Россия
Гусарова Евгения Олеговна — младший научный сотрудник отдела биофизических методов исследования, врач высшей категории.
ул. Варнинская, 4-71, Челябинск
М. В. Павличенко
Россия
Павличенко Мария Васильевна — кандидат медицинских наук, заведующая отделением детей раннего возраста, врач-педиатр высшей категории.
ул. Гражданская, 2-264, Екатеринбург
Я. Ю. Поспелова
Россия
Поспелова Яна Юрьевна — кандидат медицинских наук, врач ультразвуковой диагностики.
ул. Энтузиастов, 29-8, Екатеринбург
О. Э. Соловьева
Россия
Соловьева Ольга Эдуардовна — доктор физико-математических наук, профессор, директор ФГБУН ИИФ УрО РАН; профессор, ФГБОУ ВО «УрФУ».
ул. Мира, д. 19, Екатеринбург, 620002; ул. Первомайская, д. 106, г. Екатеринбург, 620078
Рецензия
Для цитирования:
Косовцова Н.В., Маркова Т.В., Чумарная Т.В., Гусарова Е.О., Павличенко М.В., Поспелова Я.Ю., Соловьева О.Э. Инновационное исследование сердца плодов при монохориальном многоплодии. Вестник охраны материнства и младенчества. 2024;1(1):64-77. https://doi.org/10.69964/BMCC-2024-1-1-64-77
For citation:
Kosovtsova N.V., Markova T.V., Chumarnaya T.V., Gusarova E.O., Pavlichenko M.V., Pospelova Ya.Yu., Solovyova O.E. Innovative study of the fetal heart in monochorionic multiple births. Bulletin of maternal and child care. 2024;1(1):64-77. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-1-64-77









