Перейти к:
Экспериментальный этап внутриутробной коррекции артериовенозной мальформации вены Галена
https://doi.org/10.69964/BMCC-2025-2-3-58-69
Аннотация
Введение. Артериовенозная мальформация вены Галена (АВМ ВГ) — редкий сосудистый порок развития центральной нервной системы, преимущественно диагностируемый в неонатальном или постнатальном периоде. Несмотря на значительные успехи в области неонатальной эндоваскулярной эмболизации, уровень летальности и частота тяжелых неврологических осложнений остаются высокими. В этой связи развитие внутриутробных хирургических технологий открывает перспективы вмешательства, направленного на предотвращение сердечно-сосудистых осложнений и гипоксического повреждения центральной нервной системы.
Цель исследования. Разработка способа внутриутробной частичной окклюзии артериовенозной мальформации вены Галена под ультразвуковым контролем в эксперименте.
Материалы и методы. Метод малоинвазивной внутриутробной эмболизации артериовенозной мальформации вены Галена относится к методам фетальной хирургии, приводит к снижению сброса крови и купированию сердечно-сосудистой недостаточности. Моделью мальформации послужило левое предсердие плода овцы. Применение данной методики утверждено на заседании этического комитета при ФГБУ «Уральский НИИ ОММ» Минздрава России от 12.09.2021.
Результаты исследования. В ходе двух экспериментальных вмешательств на модели артериовенозной мальформации вены Галена, смоделированной на плодах овец, была успешно выполнена частичная внутриутробная эмболизация с применением микроспиралей и клеевых композиций. Установлено, что данная методика обеспечивает значительное снижение скорости кровотока в камерах сердца (в 3–4 раза), без интраоперационных нарушений сердечной деятельности плодов. Использование адгезивной композиции позволило предотвратить миграцию спиралей. Все плоды остались живы на момент завершения экспериментов.
Заключение. Предложенная методика частичной внутриутробной эмболизации артериовенозной мальформации вены Галена в эксперименте показала потенциальную эффективность в снижении кровотока через аневризматически изменённый сосуд. Полученные данные подтверждают возможность безопасного введения эмболизирующего материала под ультразвуковым контролем, что позволяет рассматривать данный подход как перспективный этап подготовки к внутриутробному лечению данной патологии у плодов группы высокого риска. Дальнейшие исследования необходимы для уточнения критериев отбора пациентов и оценки клинической эффективности предложенного метода.
Для цитирования:
Косовцова Н.В., Мавлютова К.А., Орлов К.Ю., Поспелова Я.Ю., Кардапольцев Л.В. Экспериментальный этап внутриутробной коррекции артериовенозной мальформации вены Галена. Вестник охраны материнства и младенчества. 2025;2(3):58-69. https://doi.org/10.69964/BMCC-2025-2-3-58-69
For citation:
Kosovtsova N.V., Mavlyutova K.A., Orlov K.Yu., Pospelova Ya.Yu., Kardapoltsev L.V. Experimental stage of intrauterine correction of the aneurysm of the vein of Galen. Bulletin of maternal and child care. 2025;2(3):58-69. (In Russ.) https://doi.org/10.69964/BMCC-2025-2-3-58-69
Актуальность
Артериовенозная мальформация вены Галена (АВМ ВГ) — редкий врожденный дефект развития сосудов головного мозга, образующийся между 6-й и 11-й неделями беременности. В основе этого дефекта лежит наличие одного или нескольких артеровенозных соединений, направляющих кровоток к стойко расширенной проксимальной части средней прозэнцефалической вены. Соответственно и формирование артериовенозной мальформации вены Галена происходит в результате нарушения процесса обратного развития прямых артериовенозных шунтов на данном сроке беременности. АВМ вены Галена составляют до 30% внутричерепных сосудистых мальформаций, встречающихся у детей [1-5].
Ультразвук — это основной метод обследования, позволяющий диагностировать АВМ ВГ. Получение диагностических изображений с помощью метода магнитного резонанса (МРТ) в последнее время стало клинически ценным дополнительным методом обследования. Ранняя пренатальная УЗД и МРТ-визуализация плода может быть применена для точной ранней стратификации риска развития необратимых изменений мозга и сердца плода при артериовенозной мальформации вены Галена, выбора времени принятия решений по внутриутробному лечению данной патологии. [5-7]
Диагностика артериовенозной мальформации вены Галена возможна во II–III триместре беременности на основании данных ультразвукового метода исследования и магнитно-резонансной томографии с оценкой головного мозга плода. В качестве диагностических признаков артериовенозной мальформации вены Галена рассматривается турбулентный артериальный и венозный характер кровотока в режиме цветового допплеровского картирования (в норме кровоток в вене Галена и венозных мозговых синусах имеет пульсативно-волнообразный характер). Также это позволяет отличить артериовенозную мальформацию вены Галена от субарахноидальной кисты, срединной межполушарной кисты при агенезии мозолистого тела (расширенного III желудочка) и порэнцефалии (Рисунок 1) [7-12].
Клинические проявления у плодов и новорожденных обычно включают сердечную недостаточность с высоким выбросом, вследствие перегрузки правых отделов сердца, а также интракраниальное кровоизлияние вследствие разрыва АВМ вены Галена. Риск неблагоприятных исходов естественного течения заболевания приближается к 90% [13-17]. Летальность новорожденных, получивших хирургическое лечение и не имеющих признаков сердечной недостаточности, достигает 40%. 46% выживших детей, имеют значительную заболеваемость [17]. Кроме того, не стоит забывать о «скрытой» антенатальной гибели плодов с диагностированной или не диагностированной АВМ вены Галена в результате критического артериовенозного сброса, а также о случаях антенатального повреждения вещества головного мозга в результате критической венозной перегрузки. Частота подобных осложнений по литературным данным составляет 10% [8].
В связи с высокой летальностью при естественном течении заболевания, невозможностью открытого микрохирургического иссечения, на современном этапе методом выбора является транскатетерная внутрисосудистая эмболизация АВМ вены Галена [15]. Несмотря на развитие эндоваскулярных (внутрисосудистых) методов лечения в постнатальном периоде, смертность новорожденных колеблется от 23% до 75% [13-15].
Количество сеансов эмболизации напрямую зависит от анатомических особенностей мальформации. Первый сеанс эмболизации оптимально выполнять в возрасте 4-5 месяцев, когда ребёнок набрал вес и окреп. Однако, если у пациента развивается сердечно-легочная недостаточность, гидроцефалия или другие признаки быстрого ухудшения состояния, выжидательная тактика неприемлема. В этом случае оперировать приходится в первые дни жизни, что значительно повышает вероятность хирургических осложнений [18]. Мы предполагаем, что у ряда пациентов прогрессирование кардиомиопатии, развившейся пренатально, наступление фатальных изменений вещества головного мозга (энцефаломаляция) можно предотвратить с помощью внутриутробного лечения.
Цель исследования — разработка методики частичной внутриутробной окклюзии артериовенозной мальформации вены Галена.
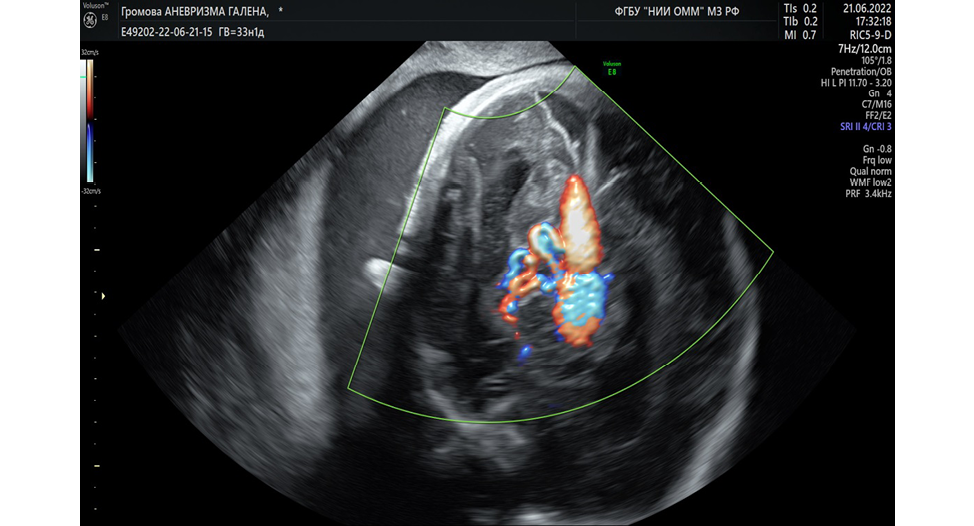
Рисунок 1. Артериовенозная мальформация вены Галена у плода в режиме цветного допплеровского картирования
Figure 1. Fetal arteriovenous malformation of the vein of Galen in Color Doppler Mode
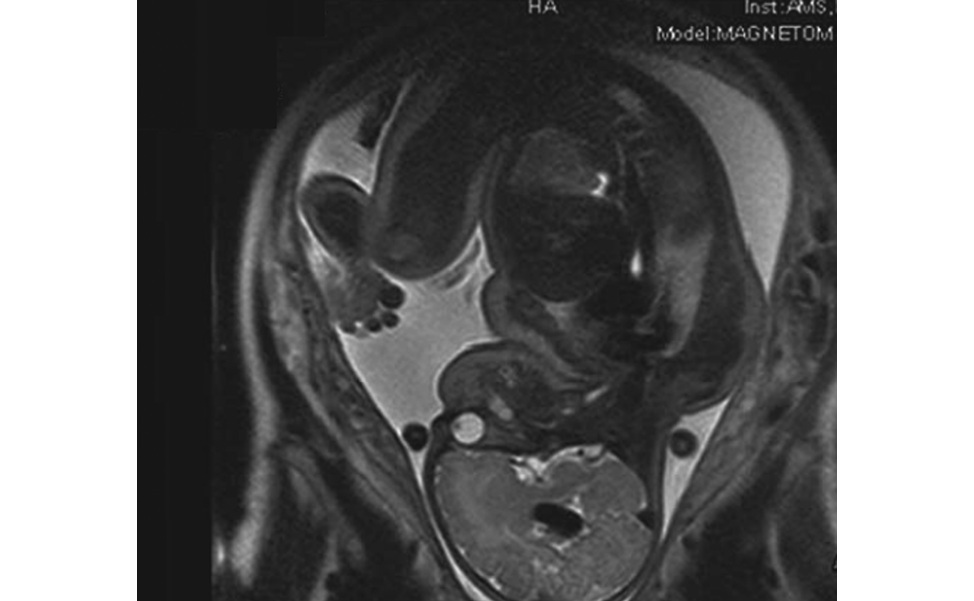
Рисунок 2. Магнитно-резонансная томография плода с артериовенозной мальформацией вены Галена
Figure 2. Magnetic resonance imaging of a fetus with arteriovenous malformation of the vein of Galen
Материалы и методы
В ФГБУ «НИИ ОММ» МЗ РФ проведен экспериментальный этап по внедрению хирургического внутриутробного лечения артериовенозной мальформации вены Галена. Применение данной методики утверждено на заседании этического комитета при ФГБУ «Уральский НИИ ОММ» Минздрава России от 12.09.2021.
Отработка внутриутробных хирургических навыков коррекции артериовенозной мальформации вены Галена с целью снижения сброса крови и купирования сердечно-сосудистой недостаточности осуществлялась с использованием двух экспериментальных животных и микроспиралей в ходе двух последовательных экспериментов.
Для апробации применялись микро катетеры сосудистые с принадлежностями «МикроВенши, Инк.», США №4, спирали для внутрисосудистой эмболизации с принадлежностями №9. Эмболизирующими агентами, применяемыми в ходе проведения эксперимента, были отделяемые микроспирали Microplex Cosmos 10 (MicroVention, США) диаметром 8mm длинной 25 см, 37 см, а также неадгезивная клеевая композиция PHIL концентрацией 35%. Доставка микроспиралей осуществлялась через совместимый микрокатетер Headway 17 150 см. Отделение микроспиралей осуществлялось специализированным контроллером V-Grip с интегрированной батареей в течение. (MicroVention, США).
Беременная овца помещалась в специальный отдельный хлев накануне операции с целью обеспечения голодной диеты за 24 часа до операции, при этом животное в достаточном количестве обеспечивается жидкостью. В день операции экспериментальное животное перемещалась в операционный зал вивария (Рисунок 3,4), где проводилась предоперационная подготовка и премедикация. При условии спонтанного дыхания животного во время манипуляций достигалась адекватная анестезия, овца на манипуляции не реагировала. Под контролем ультразвукового исследования плод обезболивался и обездвиживался. На протяжении всей манипуляции контролировалась частота сердечных сокращений (ЧСС) беременной овцы и плода. После введения в наркоз животное фиксировалось на операционном столе с инклинацией влево на 15º, с целью избежания аорто–кавального компрессионного синдрома.
Моделью артериовенозной мальформации вены Галена послужили камеры сердца плода овцы. Основанием данного выбора являлся высокоскоростной поток крови в полостях сердца. При допплерометрии, перед операцией, зафиксирована скорость потока через митральный клапан — 159 см/c, ЧСС 195 ударов в мин (Рисунок 5).
Под контролем УЗИ плоду экспериментального животного иглой 18G пунктировалось левое предсердие, выбранное в качестве модели артериовенозной мальформации вены Галена. Через просвет иглы 18G в полость левого предсердия укладывались 3 отделяемых микроспиралей с диаметром витка 5-10 мм и длиной 10-40 см в виде «клубка». При удовлетворительном размещении микроспирали производилось ее отделение. У первого экспериментального животного было зафиксирована миграция первой спирали в левый желудочек.
По данным УЗИ нарушений со стороны сердечной деятельности позиционирование спиралей в полости предсердия плода экспериментальных животных не вызвало, скорость кровотока через атриовентрикулярные клапаны после частичной эмболизации снизилась до 57,7 см /с. (Рисунок 6).
При работе со вторым экспериментальным животным в рамках эксперимента нами была опробована методика применения адгезивной цианакрилтной клеевой композиции с целью фиксации спиралей. При проведении частичной эмболизации левого предсердия у второго экспериментального животного признаков миграции спиралей не зафиксировано (Рисунок 7).

Рисунок 3. Подготовка животного к эксперименту
Figure 3. Preparing the animal for the experiment
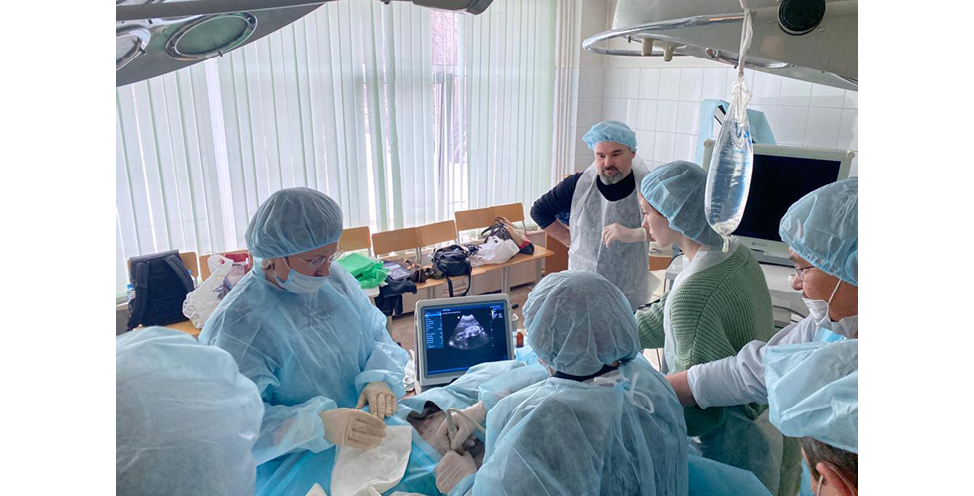
Рисунок 4. Проведение оперативного вмешательства под контролем ультразвукового исследования
Figure 4. Carrying out surgical intervention under ultrasound control
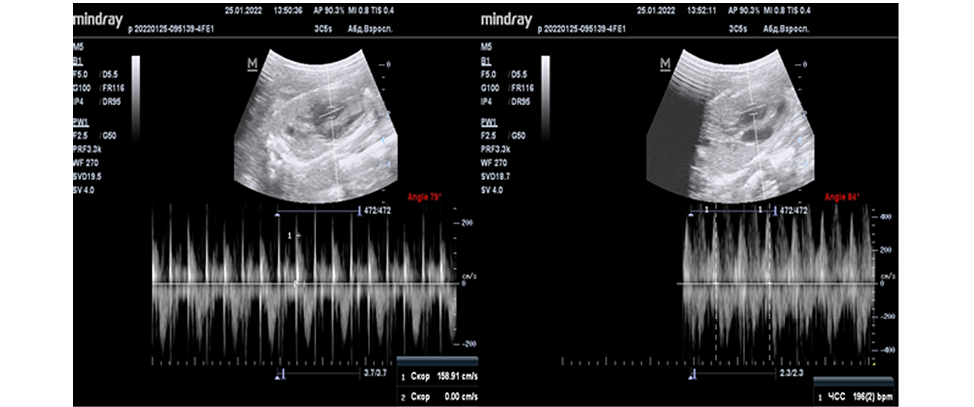
Рисунок 5. Проведение предоперационного ультразвукового контроля. Скорость кровотока через атриовентрикулярные клапаны V=159 см/с., ЧСС 196 ударов в мин.
Figure 5. Conducting preoperative ultrasound control. Blood flow velocity through the atrioventricular valves V=159 cm/s, heart rate 196 beats per minute
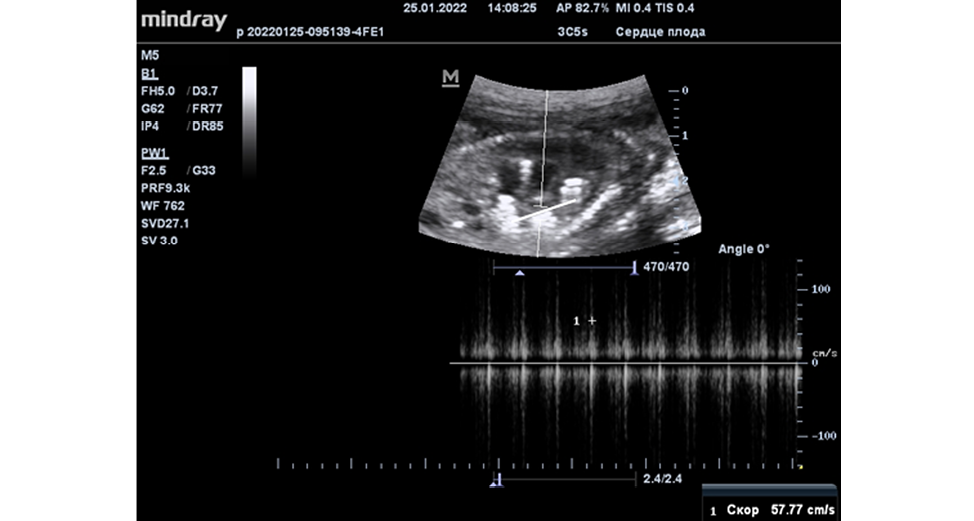
Рисунок 6. Скорость кровотока через атриовентрикулярные клапаны после эмболизации составила 57,7 см/с
Figure 6. Blood flow velocity through the atrioventricular valves after embolization was 57.7 cm/s
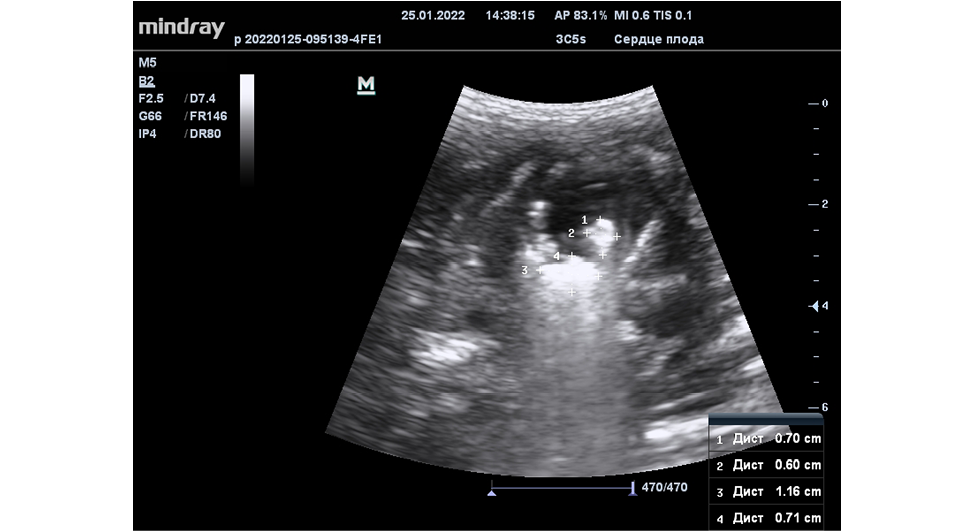
Рисунок 7. Имплантация трех микроспиралей в полость левого предсердия плода у второго экспериментального животного
Figure 7. Implantation of three microspirals into the cavity of the left atrium of the fetus in the second experimental animal
Результаты исследования
В результате проведенных нами двух экспериментов была показана возможность выполнения внутриутробной частичной эмболизации модели артериовенозной мальформации вены Галена. Было описано и подтверждено, что метод позволяет доставить эмболизирующий агент (отделяемые микроспирали) в полость модели артериовенозной мальформации вены Галена, а также обеспечить безопасное извлечение пункционной иглы. Проводившаяся на каждом этапе операции допплерометрия кровотока через предсердие и клапан, подтвердила снижение скорости кровотока через митральный клапана в 3-4 раза.
Плоды животных на момент завершения экспериментов были живы.
Обсуждение
Развитие эндоваскулярных методик, в сочетании с достижениями в области интенсивной терапии, способствует отсрочке эндоваскулярного лечения до 4-6 месяцев жизни детей (в соответствии с критериями Bicêtre score), когда использование поэтапного подхода, направленного на постепенное уменьшение артериовенозного шунтирования [6][14].
Централизация помощи в специализированных многопрофильных педиатрических центрах благоприятно сказывается на снижение смертности от артериовенозной мальформации вены Галена [6][14].
Lasjaunias et al. в 2006 г опубликовали исследование с участием 216 детей, получавших эндоваскулярное лечение АВМ ВГ. Из 216 пациентов 23 (10,6%) умерли, несмотря на проведенную эмболизацию; 20 (10,4%) выживших пациентов из 193 имели тяжелую умственную отсталость, 30 (15,6%) — умеренную умственную отсталость, а 143 (74%) пациента были неврологически здоровы [6].
В 2020 г Kartik Bhatia et al. продемонстрировали результаты собственного исследования, где исходы эндоваскулярного лечения улучшились, но по-прежнему были связаны со смертностью или заболеваемостью примерно в одной трети случаев, с наихудшими исходами среди пациентов, которым требовалось экстренное лечение в неонатальном периоде [18].
Улучшение клинических исходов, а также снижение заболеваемости может быть достигнуто путем отбора пациентов без церебрального паренхиматозного повреждения головного мозга или тяжелого мультисистемного поражения плода [6][7][11].
Летальность пациентов с артериовенозной мальформацией вены Галена, как правило, увеличивается в неонатальном периоде, если не проводится своевременное лечение. У некоторых пациентов, имеющих пренатально сформировавшуюся кардиомиопатию на фоне АВМ вены Галена, прогрессирование данных повреждений можно предотвратить с помощью внутриутробного эндоваскулярного лечения, кроме того эти пациенты могут иметь приемлемый неврологический исход.
L. Arkoetal. в 2020 стремились выявить предикторы неблагоприятного исхода при АВМ ВГ, по данным МРТ головного мозга, полученные при сканировании плода [19]. Всего было проанализированы данные 15 плодов с артериовенозной мальформацией вены Галена. Максимальный медиолатеральный диаметр (площадь под кривой = 0,980, P = 0,003) и площадь поперечного сечения (площадь под кривой = 0,941, п = 0,007) в самом узком месте прямого синуса или синуса Фальцини были высоко патогномоничны для группы неонатального риска при данной патологии [19].
Когорта пациентов неонатального риска составляет примерно две трети всех новорожденных с артериовенозной мальформацией вены Галена и имеет высокий уровень смертности и заболеваемости, несмотря на достижения в эндоваскулярном лечении [20][21].
Новорожденных с АВМ вены Галена необходимо подразделять на 3 когорты:
- первая когорта — пациенты, которые нуждаются в срочной постнатальной парциальной эмболизации АВМ вены Галена для уменьшения артериовенозногосброса и купирования сердечно-легочной недостаточности. Риск осложнений эндоваскулярного лечения крайне высокий даже при квалифицированной помощи;
- вторая когорта — пациенты, эмболизация АВМ вены Галена у которых может быть отложена до младенческого возраста с гораздо меньшим риском осложнений эндоваскулярного лечения;
- третья когорта — пациенты, которым не показано лечение, так как внутриутробно произошли тотальные органные изменения, не подлежавшие коррекции. Прогноз у этой группы абсолютно неблагоприятный.
Полученные данные позволяют предположить возможность частичной внутриутробной эмболизации АВМ вены Галена у пациентов первой когорты, а также данный метод позволит пациентам из третьей когорты получить лечение до наступления фатальных изменений паренхимы головного мозга.
Заключение
Предлагаемая нами методика позволяет отработать операцию, направленную на снижение скорости кровотока через аневризматически расширенную вену Галена при собственно функционирующей артериовенозной мальформации, предотвращая развитие осложнений со стороны сердечно — сосудистой системы плода.
Сложная в техническом исполнении операция облитерации микроспиралями мальформации вены Галена у плода явилась поводом для разработки данной операции в эксперименте, что является закономерным началом рационального, многостороннего клинического процесса, позволяющего получить положительный результат, связанный, прежде всего с предотвращением перинатальных потерь.
Ранняя пренатальная диагностика и своевременно начатое внутриутробное и постнатальное хирургическое лечение позволят в большинстве случаев предотвратить развитие осложнений и неблагоприятный исход заболеваний центральной нервной системы (ЦНС) у новорожденных. Данная технология будет способствовать улучшению показателей пренатальной заболеваемости и исходов внутриутробной хирургической помощи.
При этом следует обратить внимание, что экспертная оценка состояния ЦНС и сердечно-сосудистой системы плода по данным МРТ и УЗИ на пренатальном этапе развития патологического процесса, позволяющая четко определить анатомические особенности сосудистого русла, послужит основой для дальнейшего обследования и лечения пациента, включающего высокотехнологичные методы.
Результаты проведенных нами экспериментов, а также данные полученные в ходе проведенного литературного обзора, позволили сформулировать показания и противопоказания к проведению внутриутробной коррекции артериовенозной мальформации вены Галена.
Список литературы
1. Bursac D. et al. Literature review and case report: Rare case of successful prenatal detection of Vein of Galen Malformation (VGAM). European Journal of Obstetrics & Gynecology and Reproductive Biology: X. 2024; 22:100306. https://doi.org/10.1016/j.eurox.2024.100306
2. Raybaud C. A., Strother C. M., Hald J. K. Aneurysms of the vein of Galen: embryonic considerations and anatomical features relating to the pathogenesis of the malformation. Neuroradiology. 1989; 31: 109-128. https://doi.org/10.1007/BF00698838
3. Cai C., Zhang Q., Shen C. Vein of Galen malformations—report of 2 cases and literature review. Frontiers of Medicine in China. 2008; 2: 317-322. https://doi.org/10.4236/oalib.1101478
4. Breysem L. et al. The value of fast MR imaging as an adjunct to ultrasound in prenatal diagnosis. European radiology. 2003; 13: 1538-1548. https://doi.org/10.1007/s00330-002-1811-6
5. Dagklis T. et al. Aneurysm of the Vein of Galen Diagnosed with MRI. Case Reports in Obstetrics and Gynecology. 2013; 2013(1): 716762. https://doi.org/10.1155/2013/716762
6. Lasjaunias P. L. et al. The management of vein of Galen aneurysmal malformations. Neurosurgery. 2006; 59 (5): 184-194. https://doi.org/10.1227/01.NEU.0000237445.39514.16
7. Herghelegiu D. et al. Antenatal diagnosis and prognostic factors of aneurysmal malformation of the vein of Galen: A case report and literature review. Medicine. 2017; 96 (30): 7483. https://doi.org/10.1097/MD.0000000000007483
8. Deloison B. et al. Hidden mortality of prenatally diagnosed vein of Galen aneurysmal malformation: retrospective study and review of the literature. Ultrasound in obstetrics & gynecology. 2012; 40 (6): 652-658. https://doi.org/10.1002/uog.11188
9. D’Amico A. et al. Outcome of fetal vein Galen aneurysmal malformations: a systematic review and meta-analysis. The Journal of Maternal-Fetal & Neonatal Medicine. 2022; 35 (25): 5312-5317. https://doi.org/10.1080/14767058.2021.1878494
10. Garcia-Monaco R. et al. Congestive cardiac manifestations from cerebrocranial arteriovenous shunts: endovascular management in 30 children. Child’s Nervous System. 1991; 7: 48-52. https://doi.org/10.1007/BF00263834
11. Hoffman H. J. et al. Aneurysms of the vein of Galen: experience at the Hospital for Sick Children, Toronto. Journal of neurosurgery. 1982; 57 (3): 316-322. https://doi.org/10.3171/jns.1982.57.3.0316
12. Gillet de Thorey A. et al. State of the art of antenatal diagnosis and management of vein of Galen aneurysmal malformations. Prenatal Diagnosis. 2022; 42 (9): 1073-1080. https://doi.org/10.1002/pd.6203
13. Orbach D. B. et al. Transuterine ultrasound-guided fetal embolization of vein of Galen malformation, eliminating postnatal pathophysiology. Stroke. 2023; 54 (6): 231-232. https://doi.org/10.1161/STROKEAHA.123.043421
14. Brinjikji W. et al. Endovascular treatment of vein of Galen malformations: a systematic review and meta-analysis. American Journal of Neuroradiology. 2017; 38 (12): 2308-2314. https://doi.org/10.3174/ajnr.A5403
15. Адаев А.Р., Яковлев С.Б., Хухлаева Е.А. Результаты лечения артериовенозных мальформаций вены Галена. Вопросы нейрохирургии им. НН Бурденко. 2012; 76 (3): 54-60.
16. Лагунавичене М. Л. и др. Спонтанная облитерация врожденной артериовенозной мальформации головного мозга в детском возрасте. Российский вестник перинатологии и педиатрии. 2020; 65 (3): 126-130.
17. Johnston I. H. et al. Vein of Galen malformation: diagnosis and management. Neurosurgery. 1987; 20 (5): 747-758. https://doi.org/10.1227/00006123-198705000-00013
18. Bhatia K. et al. Factors contributing to major neurological complications from vein of Galen malformation embolization. JAMA neurology. 2020; 77(8): 992-999. https://doi.org/10.1001/jamaneurol.2020.0825
19. Arko L. et al. Fetal and neonatal MRI predictors of aggressive early clinical course in vein of Galen malformation. American Journal of Neuroradiology. 2020; 41(6): 1105-1111. https://doi.org/10.3174/ajnr.A6585
20. Berestov V. et al. Huge cerebral pial arteriovenous fistula in a newborn: illustrative case. Journal of Neurosurgery: Case Lessons. 2022; 4 (16). https://doi.org/10.3171/CASE22294
21. Orlov K. et al. Superselective transvenous embolization with Onyx and n-BCA for vein of Galen aneurysmal malformations with restricted transarterial access: safety, efficacy, and technical aspects. Child’s Nervous System. 2017; 33: 2003-2010. https://doi.org/10.1007/s00381-017-3499-6
Об авторах
Н. В. КосовцоваРоссия
Косовцова Наталья Владимировна - доктор медицинских наук, руководитель отдела биофизических методов исследования, врач высшей категории
ул. Репина, д. 1, г. Екатеринбург, 620028
Телефон: +7 (912) 265-91-69
К. А. Мавлютова
Россия
Мавлютова Камилла Айратовна - врач рентгенэндоваскулярной диагностики и лечения высшей категории
ул. Волгоградская д. 185, г. Екатеринбург, 620102
Рабочий телефон: +7 (343) 363-03-03
К. Ю. Орлов
Россия
Орлов Кирилл Юрьевич - д.м.н. врач нейрохирург
117513, г. Москва, улица Островитянова, 1, стр. 10
Телефон: +7 (383) 328‒10‒40
Я. Ю. Поспелова
Россия
Поспелова Яна Юрьевна - кандидат медицинских наук, врач ультразвуковой диагностики
ул. Репина, д. 1, г. Екатеринбург, 620028
Телефон: +7 (922) 142-13-31
Л. В. Кардапольцев
Россия
Кардапольцев Лев Владимирович - заведующий отделением рентгенохирургических методов диагностики и лечения, врач высшей категории
620102, Екатеринбург, ул. Волгоградская, 185
Рабочий телефон: +7 (343) 363-03-03
Рецензия
Для цитирования:
Косовцова Н.В., Мавлютова К.А., Орлов К.Ю., Поспелова Я.Ю., Кардапольцев Л.В. Экспериментальный этап внутриутробной коррекции артериовенозной мальформации вены Галена. Вестник охраны материнства и младенчества. 2025;2(3):58-69. https://doi.org/10.69964/BMCC-2025-2-3-58-69
For citation:
Kosovtsova N.V., Mavlyutova K.A., Orlov K.Yu., Pospelova Ya.Yu., Kardapoltsev L.V. Experimental stage of intrauterine correction of the aneurysm of the vein of Galen. Bulletin of maternal and child care. 2025;2(3):58-69. (In Russ.) https://doi.org/10.69964/BMCC-2025-2-3-58-69









