Перейти к:
Анемии неясного генеза у плода и новорожденного, симбиоз акушерской и неонатальной помощи (обзор литературы и клинический пример)
https://doi.org/10.69964/BMCC-2025-2-3-38-49
Аннотация
Актуальность. Врожденная анемия является одной из актуальных проблем перинатальной диагностики ввиду высокой частоты встречаемости и риска развития тяжелых осложнений плода и новорожденного. В связи с этим, изучение и совершенствование подходов к диагностике и терапии фетальной анемии остаются важной задачей современной перинатологии.
Цель. Представить современный подход к диагностике и лечению врожденной анемии у плода и новорожденного на основании анализа современных литературных данных и клинического случая.
Материалы и методы. Для исследования использован обзор литературы за последние 10 лет из баз данных Medline, Scopus, Web of Science, Google Scholar, PubMed, Wiley и Cochrane Library. Проанализирован клинический случай диссоциированной дихориальной двойни с тяжелой анемией одного из плодов.
Результаты. Рассмотрены основные причины врожденной анемии — изоиммунизация, фетальная кровопотеря, внутриутробная инфекция, генетические и опухолевые заболевания. Подчеркнута ключевая роль неинвазивной диагностики анемии у плода с помощью измерения максимальной систолической скорости в средней мозговой артерии. Продемонстрирована эффективность внутриутробного переливания крови как основного методом лечения тяжелой анемии. На примере клинического случая показаны сложности дифференциальной диагностики, связанные с возможностью развития синдрома анемии-полицитемии при дихориальной плацентации, а также влиянием внутриутробной инфекции и патологии пуповины на формирование анемии. Своевременное проведение пренатальной диагностики, внутриутробных переливаний и последующего постнатального лечения обеспечило благоприятный перинатальный исход.
Заключение. Анализ литературы и клинического случая демонстрируют важность своевременного мультидисциплинарного и индивидуализированного подхода к диагностике и лечению врожденной анемии с использованием современных ультразвуковых технологий и внутриутробных вмешательств для улучшения прогноза у плодов и новорожденных.
Ключевые слова
Для цитирования:
Климова И.В., Панов А.Е., Коцуба Д.Р., Безлепкина М.Б., Шакая М.Н., Махукова Н.А., Ярыгина Т.А. Анемии неясного генеза у плода и новорожденного, симбиоз акушерской и неонатальной помощи (обзор литературы и клинический пример). Вестник охраны материнства и младенчества. 2025;2(3):38-49. https://doi.org/10.69964/BMCC-2025-2-3-38-49
For citation:
Klimova I.V., Panov A.E., Kotsuba D.R., Bezlepkina M.B., Shakaya M.N., Makhukova N.A., Yarygina T.A. Anemias of unknown etiology in the fetus and newborn: the symbiosis of obstetric and neonatal care (literature review and clinical case). Bulletin of maternal and child care. 2025;2(3):38-49. (In Russ.) https://doi.org/10.69964/BMCC-2025-2-3-38-49
Фетальная анемия — это патологическое снижение концентрации гемоглобина и/или гематокрита у плода более, чем на 2 стандартных отклонения от среднего значения для гестационного возраста, возникающее внутриутробно и имеющее разнообразные этиологические факторы. [1][2].
Этиология
Установлено, что основными причинами развития врожденной анемии являются материнская аллоиммунизация, фетальная кровопотеря и парвовирусная инфекция (таблица 1) [3][4].
Гемолитическая болезнь плода возникает вследствие изоиммунзиации матери к эритроцитарным антгенам плода (чаще всего по системе Rh или другим антигенам, например Kell, Duffy, Kidd). Иммуноглобулины класса IgG проникают через плаценту и вызывают гемолиз эритроцитов плода, что является основной причиной фетальной анемии. Несмотря на стандартизированные протоколы иммуноглобулиновой профилактики резус-конфликта, случаи болезни продолжают возникать чаще всего из-за неадекватного дозирования или пропуска профилактических мероприятий профилактики антенатальных сенсибилизирующих событий, недостаточной комплаентности пациентов, отсутствия профилактики по другим эритроцитарным антигенам, а также из-за переливаний крови женщинам репродуктивного возраста [5–7].
Фетальная кровопотеря при многоплодии
Причины анемии плода при осложнениях монохориального многоплодия связаны с особенностями сосудистого строения общей плаценты и нарушением кровообращения между плодами. К анемии плода могут привести такие осложнения как фетофетальный трансфузионный синдром (ФФТС), при котором происходит неравномерный сброс крови от донора к реципиенту через плацентарные анастомозы, что приводит к гиповолемии и анемии у донора и полицитемии у реципиента. Кроме того, синдром анемии-полицитемии(САП) — форма хронической, медленно текущей фето-фетальной трансфузии через мелкие глубокие артериовенозные анастомозы малого диаметра, при которой у донора развивается тяжелая анемия, а у реципиента- полицитемия. А также внутриутробная гибель одного из плодов при многоплодной беременности, что связано с кострой гиповолемии и анемии у выжившего близнеца [8–10].
Феномен фетоматеринской трансфузии (плодово-материнское кровотечение) — это проникновение крови плода в материнский кровоток до или во время родов. Объем кровопотери до 0.1-0.2 мл считается физиологическим, тогда как потеря свыше 80 мл ассоциируется с тяжелой врожденной анемией, а более 100 мл может привести к внутриутробной гибели плода. Механизмы массивных трансфузий, вероятно, связаны с повреждением трофобласта воспалительными или механическими факторами и остаются недостаточно изученными. Для количественной оценки фетальных эритроцитов в крови матери применяют тест Клейхауэра–Бетке и более точную проточную цитометрию [11][12].
Внутриутробные инфекции
Анемия плода при внутриутробной инфекции развивается вследствие угнетения костномозгового кроветворения вирусами и другими патогенами, что снижает продукцию эритроцитов. Основными возбудителями являются парвовирус B19, цитомегаловирус, герпес, токсоплазма, врожденный сифилис и краснуха. Парвовирус B19 является наиболее частая причиной тяжелой анемии и неиммунной водянки плода, сопровождающейся выраженной ретикулоцитопенией. Тяжесть анемии зависит от степени подавления эритропоэза и может привести к развитию водянки плода и внутриутробной смерти [13–15].
Генетические нарушения
Генетические заболевания, приводящие к анемии плода, представляют собой разнообразную группу нарушений, связанных с дефектами эритроцитов, гемоглобина или процессов кроветворения. Гемоглобинопатии и талассемии, врожденные дизэритропоэтические анемии (CDA), серповидноклеточная анемия, анемия Даймонда-Блекфена, дефекты мембраны эритроцитов и ферментопатии, которые проявляются тяжелой, зависимой от переливания крови анемией, иногда с водянкой плода и высоким уровнем фетального гемоглобина [16, 17].
Опухоли
Плацентарные хориоангиомы являются наиболее распространенной доброкачественной опухолью плаценты и при больших размерах они могут вызвать анемию у плода. Основными механизмы развития анемии плода включают фетоматеринскую трансфузию и микроангиопатическую гемолитическую анемию, обусловленную захватом и разрушением эритроцитов плода в сосудистой сети хориоангиомы. Несмотря на усиленный эритропоэз, плод не способен восполнить дефицит эритроцитов из-за депонирования крови плода сосудистом пространстве хорионангиомы. [18]. Опухоли крестцово-копчиковой области плода также могут привести к анемии плода со вторичной сердечной недостаточностью высокой интенсивности и водянкой [19].
Таблица 1. Этиология фетальных анемий
Table 1. Etiology of fetal anemia.
Категория | Причины |
Иммунные | Аллоиммунизация эритроцитов: Против антигенов резус системы (D,c), системы Kell, Duffy, Kidd и др. |
Фетальная кровопотеря | Осложнения многоплодия (ФФТС, САП) Плодово-материнское кровотечение Акушерские осложнения (отслойка плаценты, гематома пуповины) Инвазивные процедуры (амниоцентез, кордоцентез) |
Инфекционные | Парвовирус B19, ЦМВ, вирусы герпеса, сифилис, токсоплазмоз |
Наследственные | Анемия Фанкони, альфа-талассемия, гемоглобинопатии, энзимопатии |
Другие | Опухоли (плацентарные хорионангиома, крестцово-копчиковая тератома у плода) |
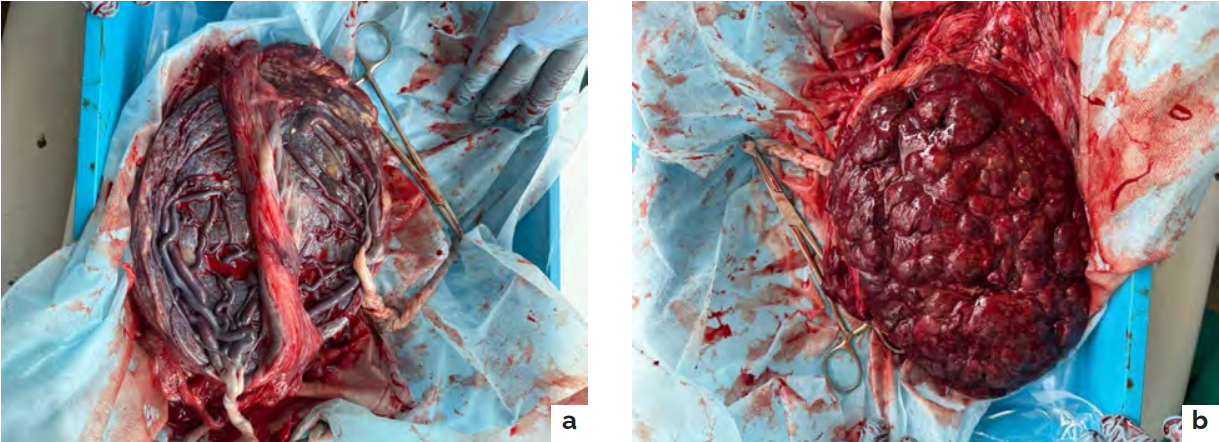
Рисунок 1. Макропрепарат плаценты: a — плодовая поверхность; b — материнская поверхность
Figure 1. Placenta macro-preparation: a — fetal surface; b — maternal surface
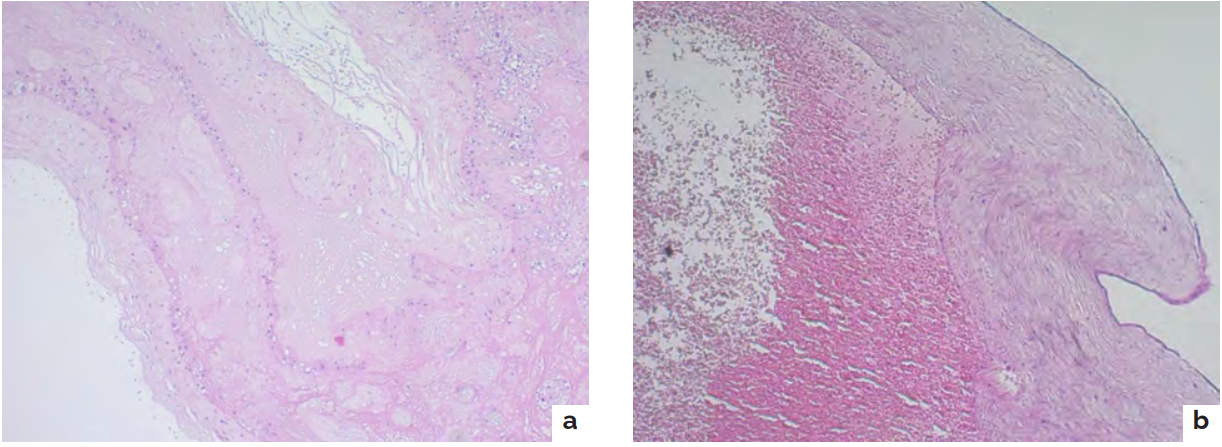
Рисунок 2. Гистологическое исследование a — ворсины хориона и цитотрофобласт в амниотической перегородке; b — ложный узел пуповины 2-го плода
Figure 2. Histological examination a — chorionic villi and cytotrophoblast in the amniotic septum; b — false node of the umbilical cord of the 2nd fetus
Диагностика
Для верификации анемии, развившейся в пренатальном периоде независимо от ее этиологии, в настоящее время широко применяются неинвазивные ультразвуковые методы, в частности, измерение максимальной скорости систолического кровотока (МССК) в средней мозговой артерии (СМА) плода с помощью допплерометрии [20][21].
Установлено, что величина МССК в СМА, начиная с конца II и на протяжении первой половины III триместра беременности, имеет выраженную корреляцию с уровнями гематокрита и гемоглобина в крови плода, получаемой при кордоцентезе. Значение МССК в СМА, превышающее 1.5 раза медианное значение (MoM), принято в качестве порогового уровня для выявления тяжелой анемии плода, поскольку при этом достигается высокая чувствительность (около 75–100%) и специфичность (около 90%) диагностики. Отсечка в 1,5 MoM выбрана как оптимальный баланс между выявлением значимых случаев анемии и минимизацией ложноположительных результатов. Значения ниже 1,29 MoM обычно соответствуют отсутствию анемии или ее легкой форме, а диапазон от 1,29 до 1,5 MoM указывает на среднетяжелую анемию [1][20].
Тактика ведения и особенности диагностики при многоплодной беременности определяются ее хориальностью, что является важным фактором стратификации рисков. Наиболее точным и воспроизводимым методом определения хориальности является комбинированное использование T/λ-знаков и количества плацент в первом триместре с чувствительностью и специфичностью 100% и 99,8% соответственно [22][23]. При дихориальной диамниотической двойне (ДХДД) близнецы разделены толстым слоем сросших хорионических мембран с двумя тонкими амниотическими слоями, по одному с каждой стороны, придавая вид «заполненной лямбды», по сравнению только с двумя тонкими амниотическими слоями, разделяющими два плода при монохориальной диамниотической беременности (МХДД) (T-призрак или пустой лямбда-знак). Однако аномальное прикрепление межплодной амниотической мембраны к плаценте в виде «пустой лямбды» вместо классического Т-признака может приводить к ошибкам в определении хориальности [24].
Анемия плода может быть результатом одного из осложнений при монохориальной беременности двойней — синдрома анемии-полицитемии (САП) [25]. САП возникает спонтанно у 3-5% монохориальных близнецов или после лазерной терапии анастомозов в 2-16% случаев [9]. Дородовая диагностика САП основана на дискордантности МССК в СМА плода с повышенной скоростью для донора, что указывает на анемию, в сочетании со снижением скорости у реципиента, что указывает на полицитемию [26].
Критерии диагностики САП с использованием допплерометрии в СМА меняются в течении времени. На настоящий момент в соответствии с клиническими рекомендациями утверждены следующие критерии: повышение МССК в СМА у донора более 1.5 МоМ в сочетании со снижением МССК в СМА у реципиента менее 0.8.МоМ [27][28]. Однако эти параметры продолжают обсуждаться.
Три недавних когортных исследования показывают, что дискордантность (или дельта) МССК в СМА >0,5 MoM является более чувствительным маркером для выявления САП, чем пороговые значения. В связи с этим рекомендована классификации САП, в которой дельта МССК в СМА более 0,5 MoM соответствует 1-й стадии, а более 0,7 MoM — 2-й стадии [29].
В последнем консенсунсе Delphi группа специалистов по медицине матери и плода и неонатологов эксперты утвердили критерии ≥1,5 MoM для донора, ≤0,8 MoM для реципиента или дельты МССК в СМА >1,0 MoM для диагностики САП [30].
Таким образом, диагностика САП основывается не только на абсолютных значениях МССК в СМА у каждого плода, но и на дискордантности скорости кровотока, что повышает точность выявления синдрома.
При послеродовой диагностике САП основным критерием является разница в уровне гемоглобина между близнецами более 8 г/дл.[31]. Поскольку дискордантность гемоглобина может иметь разные причины, используются два дополнительных показателя: коэффициент количества ретикулоцитов (‰) выше 1,7 [32] и наличие мелких плацентарных анастомозов диаметром менее 1 мм, выявленных с помощью инъекции цветного красителя[31].
Ряд авторов отмечают наличие осложнений, характерных для монохориальной двойни таких как ФФТС, САП и синдрома обратной артериальной перфузии при дихориальной двойне [33–38]. Авторами отмечено, что случаи, которые тестировалась на зиготность, продемонстрировали монозиготность [38][39]. В связи с чем при выявлении таких сложных спорных ситуаций рекомендуется определять зиготность с помощью хромосомного матричного анализа амниотической жидкости плодов или секвенирования ДНК материнской плазмы, а постнатальном периоде — проводить полноэкзомное секвенирование [40][41].
Алгоритм действия
Алгоритм действия при анемии плода зависти от ее причины, степени тяжести состояния плода и срока беременности.
При анемии вызванной изоиммунизацией при значениях МССК СМА 1,5 МоМ и более учитывая, высокую вероятность тяжелой анемии у плода повторное УЗИ проводят через 2-3 дня. При нарастании МССК СМА показано проведение кордоцентеза с последующим применять внутриутробные внутрисосудистые переливания плоду отмытых эритроцитов [20].
При монохориальном многоплодии при обнаружении анемии плода тяжёлой степени в сроках от 16 до 26 недель рекомендована фетоскопическая лазерная коагуляция сосудистых анастомозов плаценты, при невозможности лазерной коагуляции сосудистых анастомозов плаценты у беременных с САП тяжёлой степени в сроках от 16 до 32 недель рекомендовано хирургическое лечение в виде внутриутробного переливания крови плоду с анемией [28].
При подозрении на внутриутробную инфекцию рекомендовано проведение серологических исследований на инфекционные заболевания (парвовирус В19, ЦМВ, герпес-вирусы, ВИЧ, сифилис), назначают патогенетическое лечение, а при наличии анемии тяжелой степени проводят внутриутробное переливание крови [15].
При отсутствии указанных причин рекомендуется выполнить тест Клейхауэра-Бетке для выявления фето-материнского кровотечения, а также при необходимости провести электрофорез гемоглобина с целью диагностики талассемии и гемоглобинопатий. [42].
Внутриутробное переливание крови является наиболее распространенным и признанным методом лечения анемии плода и может применяться при большинстве этиологий анемии, перечисленных выше. Этот метод позволяет значительно повысить выживаемость плода и снизить риски осложнений, связанных с тяжелой анемией.
Клинический случай
Мы представляем клинический случай у пациентки с диссоциированной дихориальной диамниотической двойней и анемией у плода.
Пациентка К. 26 лет была госпитализирована в ГБУЗ МО МОНИИАГ на сроке беременности 31 нед 6 дн с угрозой преждевременных родов. Беременность наступила спонтанно, осложнялась угрозой прерывания в первом триместре с ретрохориальной гематомой. При раннем пренатальном скрининге диагностирована дихориальная диамниотическая двойня с низким риском хромосомных аномалий, однако в протоколе УЗИ не указано количество хорионов, не описан тип прикрепления межплодной амниотической мембраны к хориону и места прикрепления пуповин.
На сроке 19 недель 6 дней, при втором ультразвуковом скрининге был выставлен диагноз монохориальной диамниотической двойни (МХДД) без выявления патологии, с ПМП первого плода 11 перцентиля по Hadlock и второго — 42 перцентиля. Контрольное УЗИ через две недели (21 неделя 6 дней) показало ПМП 6,3 и 47 перцентилей соответственно, при этом был установлен диагноз дихориальной диамниотической двойни (ДХДД) на основании выявления лямбда-признака и наличия двух желтых тел в яичниках. В связи с дискордантностью размеров плодов рекомендована консультация генетика и амниоцентез для проведения хромосомного микроматричного анализа, от которого пациентка отказалась.
Пациентка впервые была консультирована в ГБУЗ МО МОНИИАГ на сроке 23 недели 6 дней беременности. Ультразвуковое исследование выявило сохраняющуюся выраженную дискордантность по предполагаемой массе плодов (ПМП): у первого плода — 3,5 перцентиль, у второго — 75 перцентиль, что позволило установить диагноз задержки роста плода (ЗРП) у первого ребенка. Морфологические параметры, количество околоплодных вод и допплерометрические показатели находились в пределах нормы.
На сроке 28–29 недель в связи с угрозой преждевременных родов пациентка проходила стационарное лечение по месту жительства, где был установлен акушерский пессарий. Диагноз ЗРП первого плода сохранялся.
При госпитализации в МОНИИАГ на сроке 32 недели 1 день ультразвуковое исследование подтвердило дискордантность по ПМП: первый плод — 5,5 перцентиль (по шкале Intergrowth), второй — 67 перцентиль. Учитывая, что во втором триместре была диагностирована МХДД, а в третьем триместре определение хориальности затруднено, для оценки состояния плодов, проведены измерения, характерные для МХДД. В частности, измерена МССК в СМА у обоих плодов с расчетом МоМ по номограмме G.Mari [43]. У 1-го плода МССК составила 48 см/с (1.09 МоМ), у 2-го плода — 64.8 см/с (1.47 МоМ).
При повторном УЗИ на сроке 33 нед. 2 д. сохранялась диссоциация по ПМП: масса 1-го плода составила 1593 г (5,1 перцентиль), второго — 2100 г (62-й перцентиль). Одновременно была выявлена значительная дискордантность по МССК в СМА: у первого плода составила 50 см/с (1.07 Мом), у второго — 85 см/с (1.82 Мом), при пороговом значении для данного срока гестации 70 см/с (1.5 МоМ), что свидетельствует о наличии признаков тяжелой анемии у 2 плода. Признаков водянки плодов не обнаружено, мочевые пузыри в норме. Кардиоторакальный индекс второго плода с анемией был в пределах нормы (27%), гипертрофии, кардиомегалии и трикуспидальной регургитации не выявлено. Также отсутствовали гидроторакс, гидроперикард, асцит и отек подкожной клетчатки, гепатомегалия и спленомегалия.
На сроке беременности 34 недели 3 дня в связи с ультразвуковыми признаками тяжелой анемии второго плода проведены трансабдоминальный амниоцентез и кордоцентез. Анализ пуповинной крови подтвердил выраженную анемию: гемоглобин составил 60 г/л, гематокрит — 16,8%. Внутриутробно выполнено переливание эритроцитарной массы, обедненной лейкоцитами и тромбоцитами (ЭМОЛТ).
При повторном обследовании в сроке 35 недель 2 дня зафиксировано дальнейшее повышение МССК в СМА второго плода до 86–90 см/с (1,67–1,89 МоМ), при пороговом значении для данного срока гестации 76.5 см/с (1.5 МоМ). Данные показатели послужили основанием для повторного кордоцентеза и повторного внутриутробного переливания ЭМОЛТ, выполненного в 35 недель 5 дней. При исследовании пуповинной крови гемоглобин составил 61 г/л, гематокрит — 16,7%. Процедура переливания была выполнена в неполном объеме из-за развития дистресса плода, что потребовало экстренного кесарева сечения.
Родились две недоношенные девочки весом 1630 г и 1980 г с выраженной диссоциацией по уровню гемоглобина: у первого ребенка — 214 г/л, у второго — 99 г/л. Второй новорожденный родился в крайне тяжелом состоянии с тяжелой асфиксией, гипоксически-ишемической энцефалопатией, врожденной пневмонией и анемией, потребовав интенсивной кардиотонической и респираторной поддержки. В связи с выраженным лейкоцитозом (55 × 10⁹/л) и сдвигом лейкоцитарной формулы влево проводилась антибактериальная терапия.
Патологоанатомическое исследование плаценты подтвердило дихориальность беременности. Было выявлено значительное несоответствие размеров плацентарных дисков с краевым прикреплением пуповин у обоих плодов (рис.1 a,b). В амниотической перегородке обнаружены две самостоятельные хориальные пластинки, с выраженным цитотрофобластом и двойным амниотическим эпителием, разделённых толстой децидуальной перегородкой (рис 2а). У второго плода диагностирован крупный ложный узел размером 5 × 2,5 см, представляющий собой аневризматически расширенную, резко извитую вену с отсутствием мышечного слоя, без признаков тромбообразования (рис 2b). Исследования красителями не были применены.
В последующем наблюдении оба ребенка достигли нормальных гематологических показателей к 1.5 месяцам жизни и находятся в удовлетворительном состоянии.
Наш случай представлял собой диагностическую дилемму. Патогенетические механизмы анемии второго плода в представленном случае, вероятно, обусловлены сочетанием нескольких факторов.
Несмотря на подтвержденную дихориальность, нельзя полностью исключить наличие минимальных сосудистых анастомозов между плацентами, поскольку гистологическое исследование без применения специальных красителей не позволило верифицировать микрососудистые связи. Косвенными признаками возможного САП служат значительная постнатальная разница в уровне гемоглобина между близнецами (более 80 г/л, 214 против 99 г/л) и дискордантность МССК в СМА более 0,5 МоМ, что соответствует консенсусу Delphi по диагностике САП при двойне. Однако критерии ISIOG, предполагающие МССК более 1,5 МоМ у анемичного плода и менее 1 МоМ у полицитемичного, не были выполнены. Постнатальные критерии требуют либо коэффициента количества ретикулоцитов >1,7, либо доказательств небольших (<1 мм) анастомозов, наблюдаемых в плаценте, которые не проводились в нашем случае из-за клинических обстоятельств.
Возможен также монозиготный вариант дихориальной двойни, при котором позднее разделение морулы или ранней бластоцисты привело к формированию двух хориальных пластинок с сохранением тканевого мостика трофобласта, способствующего развитию сосудистых анастомозов [38]. Механические и анатомические особенности имплантации и формирования плацент могли создать условия для локального ангиогенеза и сосудистых связей между близнецами, что не исключает наличие микроанастомозов, не выявленных при исследовании плаценты.
Кроме того, внутриутробная инфекция, подтверждаемая выраженным лейкоцитозом со сдвигом лейкоцитарной формулы влево (55 × 10⁹/л) и наличием врожденной пневмонии в сочетании с патологией пуповины в виде ложного узла по типу аневризмы вены пуповины у второго плода могли способствовать развитию вторичной анемии.
Плодово-материнское кровотечение мы не можем отвергнуть или подтвердить, так как не имеем данных пробы Клейхауэра-Бетке.
Случай демонстрирует сложности дифференциальной диагностики анемии при ДХДД и требует междисциплинарного подхода. Несмотря на традиционное представление о том, что сосудистые анастомозы характерны преимущественно для монохориальных беременностей, современные данные свидетельствуют о возможности формирования микроанастомозов и при дихориальной двойне, что требует повышенного внимания к мониторингу и индивидуализации тактики ведения таких беременностей. Учитывая вариабельность клинических исходов при анемии у ДХДД следует рассматривать широкий спектр лечебных подходов — от тщательного наблюдения до внутриутробных переливаний крови. Ранняя диагностика анемии различной этиологии с помощью измерения МССК в СМА и своевременное проведение внутриутробных вмешательств позволяют улучшить перинатальный прогноз.
Список литературы
1. Mari G, Norton ME, Stone J, Berghella V, Sciscione AC, Tate D, et al. Society for Maternal-Fetal Medicine (SMFM) Clinical Guideline #8: The fetus at risk for anemia–diagnosis and management. American Journal of Obstetrics & Gynecology. 2015;212:697–710. https://doi.org/10.1016/j.ajog.2015.01.059
2. Врожденная анемия вследствие кровопотери у плода и другие врожденные анемии новорожденных. Клинические рекомендации. Министерство Здравоохранения Российской Федерации. 2024. https://cr.minzdrav.gov.ru/view-cr/660_2
3. Заплатников А.Л., Подзолкова М.Н., Пониманская М.А., Денисова Ю.В., Дмитриев А.В., Дементьев А.А. Врожденная анемия: алгоритм диагностики. РМЖ Мать и дитя. 2022;5:358–65. https://doi.org/10.32364/2618-8430-2022-5-4-358-365
4. Abbasi N, Johnson J.-A., Ryan G. Fetal anemia. Ultrasound in Obstetrics & Gynecology. 2017;50:145–53. https://doi.org/10.1002/uog.17555
5. Hendrickson JE, Delaney M. Hemolytic Disease of the Fetus and Newborn: Modern Practice and Future Investigations. Transfus Med Rev. 2016;30:159–64. https://doi.org/10.1016/j.tmrv.2016.05.008
6. Christensen RD, Bahr TM, Ilstrup SJ, Dizon-Townson DS. Alloimmune hemolytic disease of the fetus and newborn: genetics, structure, and function of the commonly involved erythrocyte antigens. J Perinatol. 2023;43:1459–67. https://doi.org/10.1038/s41372-023-01785-3
7. Дударева Ю.А., Корчагина А.В., Гурьева В.А., Щанова Е.Н. Прогностические маркеры формирования тяжелой формы гемолитической болезни плоди и новорожденного при резус-изоиммунизации. Бюллетень медицинской науки. 2021;4:5–11. https://doi.org/10.31684/25418475-2021-4-5
8. Lewi L. What fetal medicine specialists should know about the monochorionic placenta. Best Pract Res Clin Obstet Gynaecol. 2022;84:17–32. https://doi.org/10.1016/j.bpobgyn.2022.03.007
9. Sorrenti S, Khalil A, D’Antonio F, D’Ambrosio V, Zullo F, D’Alberti E, et al. Counselling in Fetal Medicine: Complications of Monochorionic Diamniotic Twin Pregnancies. J Clin Med. 2024;13:7295. https://doi.org/10.3390/jcm13237295
10. Tollenaar LSA, Slaghekke F, Middeldorp JM, Lopriore E. Fetal anemia in monochorionic twins: a review on diagnosis, management, and outcome. Expert Rev Hematol. 2023;16:9–16. https://doi.org/10.1080/17474086.2023.2166921
11. Boller MJ, Moore GS, Hung Y-Y, Weintraub MLR, Schauer GM. Fetomaternal hemorrhage: evaluation of recurrence within a large integrated healthcare system. American Journal of Obstetrics & Gynecology. 2021;225:540.e1-540.e8. https://doi.org/10.1016/j.ajog.2021.04.257
12. Derme M, Vasta A, Tibaldi V, Galoppi P, D’Ambrosio V, Di Mascio D, et al. Diagnosis of Spontaneous Massive Fetomaternal Hemorrhage: A Case Report and Literature Review. J Clin Ultrasound. 2025. https://doi.org/10.1002/jcu.24062
13. Mascio DD, Buca D, Rizzo G, Giancotti A, D’Amico A, Leombroni M, et al. VP12.03: Outcome of fetuses with congenital cytomegalovirus infection: a systematic review and meta-analysis. Ultrasound in Obstetrics & Gynecology. 2020;56:99–100. https://doi.org/10.1002/uog.22502
14. Olejniczak O, Kornacki J, Boroń D, Gutaj P, Iciek R, Wender-Ożegowska E. Parvovirus B19 Infection in Pregnancy—Course of the Disease, Fetal Complications and Management Tools: A Case Series and Literature Review. Children (Basel). 2024;11:1037. https://doi.org/10.3390/children11091037
15. Munoz JL, Benitez L, Buskmiller C, Nassr AA, Belfort MA, Cortes MS, et al. Clinical Characteristics and Outcomes of Intrauterine Blood Transfusion (IUT) for Infectious Etiologies. Prenat Diagn. 2024;44:1622–7. https://doi.org/10.1002/pd.6671
16. Jamwal M, Aggarwal A, Sharma P, Bansal D, Das R. Congenital dyserythropoietic anemia type IV with high fetal hemoglobin caused by heterozygous KLF1 p.Glu325Lys: first report in an Indian infant. Ann Hematol. 2021;100:281–3. https://doi.org/10.1007/s00277-020-03982-y
17. Prefumo F, Fichera A, Fratelli N, Sartori E. Fetal anemia: Diagnosis and management. Best Pract Res Clin Obstet Gynaecol. 2019;58:2–14. https://doi.org/10.1016/j.bpobgyn.2019.01.001
18. Hamzeh C, Green J, Hamadeh G, Korst LM, Chmait RH. Increased Intrauterine Transfusion Blood Volume Needed to Correct Fetal Anemia due to Placental Chorioangioma. Fetal Diagn Ther. 2025;52:90–6. https://doi.org/10.1159/000541560
19. Jouzova A, Jouza M, Turek J, Gerychova R, Jezova M, Janku P, et al. Sacrococcygeal teratoma — prognosis based on prenatal ultrasound diagnosis, single-center experience and literature review. BMC Pregnancy Childbirth. 2025;25:469. https://doi.org/10.1186/s12884-025-07494-3
20. Резус-изоиммунизация. Гемолитическая болезнь плода. Клинические рекомендации. Министерство Здравоохранения Российской Федерации. 2024. https://cr.minzdrav.gov.ru/view-cr/596_3?ysclid-=mbe330l4pt51646989
21. Mari G. Middle cerebral artery peak systolic velocity: is it the standard of care for the diagnosis of fetal anemia? J Ultrasound Med. 2005;24:697–702. https://doi.org/10.7863/jum.2005.24.5.697
22. Dias T, Ladd S, Mahsud-Dornan S, Bhide A, Papageorghiou AT, Thilaganathan B. Systematic labeling of twin pregnancies on ultrasound. Ultrasound Obstet Gynecol. 2011;38:130–3. https://doi.org/10.1002/uog.8990
23. Sileo FG, Sorrenti S, Giancotti A, Di Mascio D, D’Ambrosio V, Zullo F, et al. Counselling in Fetal Medicine: Uncomplicated Twin Pregnancies. J Clin Med. 2024;13:7355. https://doi.org/10.3390/jcm13237355
24. Steenhaut P, Hubinont C, Steenhaut P, Hubinont C. Perinatal Mortality in Multiple Pregnancy. In: Perinatal Mortality. IntechOpen; 2012. https://doi.org/10.5772/32441
25. Tollenaar LSA, Lopriore E, Oepkes D, Haak MC, Klumper FJCM, Middeldorp JM, et al. Twin anemia polycythemia sequence: knowledge and insights after 15 years of research. Maternal-Fetal Medicine. 2021;3:33–41. https://doi.org/doi:10.1097/FM9.0000000000000065
26. Khalil A, Sotiriadis A, Baschat A, Bhide A, Gratacós E, Hecher K, et al. ISUOG Practice Guidelines (updated): role of ultrasound in twin pregnancy. Ultrasound in Obstet and Gynecology. 2025;65:253–76. https://doi.org/10.1002/uog.15821
27. Slaghekke F, Kist WJ, Oepkes D, Pasman SA, Middeldorp JM, Klumper FJ, et al. Twin anemia-polycythemia sequence: diagnostic criteria, classification, perinatal management and outcome. Fetal Diagn Ther. 2010;27:181–90. https://doi.org/10.1159/000304512
28. Многоплодная беременность. Клинические рекомендации. Министерство Здравоохранения Российской Федерации. 2024. https://cr.minzdrav.gov.ru/viewcr/638_2 дата обращения 2 июня 2025 г.
29. Tollenaar LSA, Lopriore E, Middeldorp JM, Haak MC, Klumper FJ, Oepkes D, et al. Improved prediction of twin anemia-polycythemia sequence by delta middle cerebral artery peak systolic velocity: new antenatal classification system. Ultrasound Obstet Gynecol. 2019;53:788–93. https://doi.org/10.1002/uog.20096
30. Khalil A, Gordijn S, Ganzevoort W, Thilaganathan B, Johnson A, Baschat AA, et al. Consensus diagnostic criteria and monitoring of twin anemia–polycythemia sequence: Delphi procedure. Ultrasound in Obstetrics & Gynecology. 2020;56:388–94. https://doi.org/10.1002/uog.21882
31. Lopriore E, Slaghekke F, Oepkes D, Middeldorp JM, Vandenbussche FPHA, Walther FJ. Hematological characteristics in neonates with twin anemia-polycythemia sequence (TAPS). Prenat Diagn. 2010;30:251–5. https://doi.org/10.1002/pd.2453
32. Fishel-Bartal M, Weisz B, Mazaki-Tovi S, Ashwal E, Chayen B, Lipitz S, et al. Can middle cerebral artery peak systolic velocity predict polycythemia in monochorionic- diamniotic twins? Evidence from a prospective cohort study. Ultrasound Obstet Gynecol. 2016;48:470–5. https://doi.org/10.1002/uog.15838
33. Zilliox M, Koch A, Favre R, Sananes N. Unusual twin anemia-polycythemia sequence in a dichorionic diamniotic pregnancy. J Gynecol Obstet Hum Reprod. 2019;48:359–61. https://doi.org/10.1016/j.jogoh.2019.02.005
34. Yoshimura Y, Ozawa K, Goto Hi, Yamazaki Y, Isohata H, Ochiai D. Twin Anemia-Polycythemia Sequence With Spontaneous Resolution in Dichorionic Diamniotic Twin Pregnancy: A Case Report and a Review of the Literature. Cureus. 16:e73563. https://doi.org/10.7759/cureus.73563
35. Kanagaretnam D, Nayyar R, Zen M. Twin anemia polycythemia sequence in dichorionic diamniotic twins: A case report and review of the literature. Clinical Case Reports. 2021;9:e04184. https://doi.org/10.1002/ccr3.4184
36. Cavazza MC, Lai AC, Sousa S, Pina R. Dichorionic pregnancy complicated by a twin-to-twin transfusion syndrome. BMJ Case Rep. 2019;12:e231614. https://doi.org/10.1136/bcr-2019-231614
37. Lanna M, Faiola S, Casati D, Rustico MA. Twin-twin transfusion syndrome in dichorionic twin pregnancy: rare but not impossible. Ultrasound Obstet Gynecol. 2019;54:417–8. https://doi.org/10.1002/uog.20195
38. Quintero R, Kontopoulos EV, Barness E, Steffensen TS, Hilbelink D, Chmait R, et al. Twin-twin transfusion syndrome in a dichorionic-monozygotic twin pregnancy: The end of a paradigm? Fetal Pediatr Pathol. 2010;29:81–8. https://doi.org/10.3109/15513811003615013
39. Murata S, Takano M, Kagawa Y, Fujiwara M, Sumie M, Nakata M. Twin-twin transfusion syndrome in a monozygotic pregnancy with obvious lambda sign in first-trimester ultrasound. Taiwan J Obstet Gynecol. 2016;55:904–6. https://doi.org/10.1016/j.tjog.2015.04.010
40. Большакова А.С., Ярыгина Т.А., Сакало В.А., Гладкова К.А., Барков И.Ю., Саделов И.О.. Наблюдение монозиготной двойни, дискордантной по множественным аномалиям развития. Акушерство и гинекология. 2023;12:205–12. https://doi.org/10.18565/aig.2023.286
41. Qu JZZ, Leung TY, Jiang P, Liao GJW, Cheng YKY, Sun H, et al. Noninvasive prenatal determination of twin zygosity by maternal plasma DNA analysis. Clin Chem. 2013;59:427–35. https://doi.org/10.1373/CLINCHEM.2012.194068
42. Maisonneuve E, Ben M’Barek I, Leblanc T, Da Costa L, Friszer S, Pernot F, et al. Managing the Unusual Causes of Fetal Anemia. Fetal Diagn Ther. 2020;47:156–6. https://doi.org/10.1159/0005015544
43. Mari G, Deter RL, Carpenter RL, Rahman F, Zimmerman R, Moise KJ, et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic Fetuses. N Engl J Med. 2000;342:9–14. https://doi.org/10.1056/nejm200001063420102
Об авторах
И. В. КлимоваРоссия
Климова Инна Владимировна - к.м.н., старший научный сотрудник отделения ультразвуковой диагностики
101000, г. Москва, ул. Покровка, д. 22а
Телефон: +7 (916) 685-92-07
А. Е. Панов
Россия
Панов Антон Евгеньевич - к.м.н., заведующий отделением ультразвуковой диагностики; врач отделения ультразвуковой диагностики
101000, г. Москва, ул. Покровка, д. 22а
129327, г. Москва, ул. Ленская, д. 15
Телефон: +7 (926) 945-03-58
Д. Р. Коцуба
Россия
Коцуба Даниил Романович - врач отделения ультразвуковой диагностики
101000, г. Москва, ул. Покровка, д. 22а
Телефон: +7 (909) 698-24-12
М. Б. Безлепкина
Россия
Безлепкина Мария Борисовна - врач анестезиолог реаниматолог, заведующая отделением реанимации и интенсивной терапии новорожденных
101000, г. Москва, ул. Покровка, д. 22а
М. Н. Шакая
Россия
Шакая Марика Нугзаровна - к.м.н., руководитель отдела новорожденных; доцент кафедры акушерства и гинекологии
101000, г. Москва, ул. Покровка, д. 22а
129110, г. Москва, ул. Щепкина, д.61/2
Tелефон: +7 (903) 769-61-60
Н. А. Махукова
Россия
Махукова Наталья Александровна - младший научный сотрудник патологоанатомического отделения
101000, г. Москва, ул. Покровка, д. 22а
Tелефон: +7(926)471-68-53
Т. А. Ярыгина
Россия
Ярыгина Тамара Александровна - к.м.н., руководитель отделения ультразвуковой диагностики; доцент кафедры ультразвуковой диагностики факультета непрерывного медицинского образования Медицинского Института; научный сотрудник Перинатального кардиологического центра
101000, г. Москва, ул. Покровка, д. 22а
117198, г. Москва, ул. Миклухо-Маклая, 6
121552, Москва, Рублевское шоссе, д. 135
Телефон: +7 (903) 004-81-22
Рецензия
Для цитирования:
Климова И.В., Панов А.Е., Коцуба Д.Р., Безлепкина М.Б., Шакая М.Н., Махукова Н.А., Ярыгина Т.А. Анемии неясного генеза у плода и новорожденного, симбиоз акушерской и неонатальной помощи (обзор литературы и клинический пример). Вестник охраны материнства и младенчества. 2025;2(3):38-49. https://doi.org/10.69964/BMCC-2025-2-3-38-49
For citation:
Klimova I.V., Panov A.E., Kotsuba D.R., Bezlepkina M.B., Shakaya M.N., Makhukova N.A., Yarygina T.A. Anemias of unknown etiology in the fetus and newborn: the symbiosis of obstetric and neonatal care (literature review and clinical case). Bulletin of maternal and child care. 2025;2(3):38-49. (In Russ.) https://doi.org/10.69964/BMCC-2025-2-3-38-49









