Перейти к:
Генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического профилей
https://doi.org/10.69964/BMCC-2024-1-3-72-79
Аннотация
Введение. Антибиотикорезистентность микроорганизмов является существенной проблемой для здравоохранения стран всего мира. Изучение структуры и распространённости генетических детерминант антибиотикорезистентности является актуальным научно- исследовательским направлением, позволяющим определить механизмы устойчивости к антибактериальным препаратам.
Цель. Изучить генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического профилей.
Материал и методы. Генетический профиль антибиотикорезистентности определяли у БЛРС-продуцирующих штаммов энтеробактерий, выделенных из образцов биологического материала, полученного от 43 женщин и 24 детей, госпитализированных в отделения ФГБУ «НИИ ОММ» Минздрава России в 2024г. ДНК бактериальных клеток БЛРС продуцирующих изолятов выделяли из суточной культуры микроорганизмов с использованием набора «ПРОБА-НК». Детекцию генов blatem, blactx-М-1, blashv; blaoxa-40-like, blaoxa-48-like, blaоxa-23-like, blaoxa-51-like, blaimp, blaKPS, blaNDM, проводили с использованием набора «БакРезиста GLA» на детектирующем амплификаторе ДТ-48 (ДНК-технология, Россия).
Результаты. У представителей семейства Enterobacteriaceae, выделенных от детей, геновариант blactx-М-1+blashv идентифицирован в 29,2% случаев и встречался только у Klebsiella pneumoniae. Blatem+blactx-М-1 детектирован в 20,8%, а blactx-М-1+blashv+blatem — в 12%. Среди представителей семейства Enterobacteriaceae, выделенных от женщин, геновариант blactx-М-1 встречался в 37,2% случаев и был выявлен только у Escherichia coli. А варианты blactx-М-1+blatem и blactx-М-1+blashv — в 16,3%. В 2024 г впервые за 7 лет проводимых нами исследований по выявлению генетических детерминант антибиотикорезистентности выявлен штамм Escherichia coli с множественной лекарственной устойчивостью, обладающий геном blaNDM. Также обращает на себя внимание выявление K. pneumoniae с генетическим профилем антибиотикорезистентности blatem, blactx-М-1, blashv, blaoxa-48-like, blaNDM.
Заключение. Генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического отделений представлен 8-ю геновариантами, в которых доминирующим геном, обеспечивающим устойчивость к бета лактамным антибиотикам среди представителей энтеробактерий в 2024г, как и в 2021, 2022 гг., остается blaCTX-M-1, который обнаруживается как в моноварианте, так и в ассоциации с blatem и blashv.
Для цитирования:
Устюжанин А.В., Чистякова Г.Н., Ремизова И.И. Генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического профилей. Вестник охраны материнства и младенчества. 2024;1(3):72-79. https://doi.org/10.69964/BMCC-2024-1-3-72-79
For citation:
Ustyuzhanin A.V., Chistyakova G.N., Remizova I.I. Genetic profile of antibiotic resistance of enterobacteria strains isolated from obstetrics, gynecology and pediatric patients. Bulletin of maternal and child care. 2024;1(3):72-79. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-3-72-79
Введение
Использование антибактериальных препаратов с лечебной и профилактической целью в медицинской практике сопровождается развитием ряда побочных эффектов, одним из которых является возникновение антибиотикорезистентности [1].
Антибактериальная терапия приводит к качественным и количественным изменениям спектра микроорганизмов в нестерильных локусах человеческого организма и способствует селекции штаммов, устойчивых к антибиотикам [2]. Изучение механизмов антибиотикорезистентности, детекция генетических детерминант в сочетании с фенотипической характеристикой имеют значение как для выбора лечебного препарата и тактики ведения конкретного пациента, так и для длительного глобального и локального микробиологического мониторинга, отражающего эволюционные закономерности распространения эпидемиологически значимых клональных линий, что в конечном итоге сказывается на эффективности эмпирической терапии как на госпитальном, так и на амбулаторном этапах оказания медицинской помощи [3].
В настоящее время распространены исследования генетического профиля антибиотикорезистентности представителей энтеробактерий, выделенных, главным образом, от взрослого населения [4]. Вместе с тем бактерии с множественной лекарственной устойчивостью зарегистрированы в качестве этиологических агентов генерализованной инфекции в учреждениях как акушерско-гинекологического, так и педиатрического профилей [5]. Вопросу рационального использования антибактериальных препаратов и микробиологическому мониторингу в учреждениях родовспоможения уделяется большое внимание [6]. Изучение структуры и распространенности генетических детерминант антибиотикорезистентности является актуальным научно- исследовательским направлением.
Цель — изучить генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического профилей.
Материалы и методы
Исследуемый материал, поступивший по клиническим показаниям и в ходе локального микробиологического мониторинга, в ходе микробиологического исследования которого обнаружены БЛРС-продуцирующие штаммы энтеробактерий, представлен в таблице 1.
Генетический профиль антибиотикорезистентности определяли у БЛРС-продуцирующих штаммов энтеробактерий, выделенных из образцов биологического материала, полученного от 43 женщин и 24 детей, госпитализированных в отделения ФГБУ «НИИ ОММ» Минздрава России в 2024г.
Для выявления детерминант устойчивости к антибактериальным препаратам были изучены 67 не дублирующих друг друга штамма 5-ти видов семейства Enterobacteriaceae (Таблица 2).
Проведение бактериологического исследования образцов биологического материала, доставленного в лабораторию осуществляли в соответствии с действующими нормативными документами (СанПин 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней»). Посев проводили на дифференциально-диагностическую питательную среду Эндо (ФБУН ГНЦ ПМБ, Россия г. Оболенск) для выделения энтеробактерий и первичной дифференциации на лактозоположительные и лактозоотрицательные колонии и на кровяно-сывороточный агар (основа-Conda, Испания) с целью выявления гемолитической активности бактериальных штаммов. Видовую идентификацию чистой культуры, определение антибиотикочувствительности проводили на бактериологическом анализаторе VITEK 2 compact (Bio Mérieux, Франция, входит в перечень оборудования ЦКП «Инновационный научно-лабораторный центр перинатальной и репродуктивной медицины» ФГБУ «НИИ ОММ» Минздрава России) согласно инструкции производителя с использованием карт VITEK 2 GN (идентификация) и AST-N360, AST-N361 (определение антибиотикочувствительности). ДНК бактериальных клеток БЛРС продуцирующих изолятов выделяли из суточной культуры микроорганизмов с использованием набора «ПРОБА-НК». Детекцию генов blatem, blactx-М-1, blashv; blaoxa-40-like, blaoxa-48-like, blaоxa-23-like, blaoxa-51-like, blaimp, blaKPS, blaNDM, проводили с использованием набора «БакРезиста GLA» на детектирующем амплификаторе ДТ-48 (ДНК-технология, Россия).
Для оценки статистической значимости различий частоты встречаемости генов использовали критерий х2 Пирсона с поправкой Йейтса.
Таблица 1. Биологический материал, при микробиологическом исследовании которого обнаружен рост БЛРС- продуцирующих бактерий
Table 1. Biological material, microbiological examination of which revealed the growth of ESBL-producing bacteria
№ п/п | Вид биологического материала Type of biological material | Количество проб Number of samples |
1 | Отделяемое цервикального канала Cervical discharge | 36 |
3 | Фекалии Feces | 20 |
4 | Кровь Blood | 3 |
9 | Моча Urine | 2 |
11 | Послед Afterbirth | 4 |
16 | Отделяемое шва Detachable seam | 1 |
17. | Отделяемое глаз eye discharge | 1 |
Итого: Total: | 67 | |
Таблица 2. Спектр видов энтеробактерий, продуцирующих БЛРС, исследованных на наличие генов антибиотикорезистентности
Table 2. Spectrum of enterobacteria species producing ESBL, investigated for the presence of antibiotic resistance genes
Вид бактерий | Количество штаммов выделенных от детей | Количество штаммов выделенных от женщин |
Escherichia coli | 8 | 32 |
Klebsiella pneumoniae | 11 | 9 |
Enterobacter cloaceae | 3 | 1 |
Proteus mirabilis | 1 | 1 |
Citrobacter freundii | 1 | 0 |
Итого | 24 | 43 |
Результаты
При изучении генетического профиля антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического профилей, идентифицировано 8 геновариантов, обеспечивающих невосприимчивость к антибиотикам группы бета лактамов.
На рисунке 1 представлен спектр генетических детерминант антибиотикорезистентности, установленный при исследовании штаммов, выделенных от детей.
У представителей семейства Enterobacteriaceae, выделенных от детей, геновариант blactx-М-1+blashv идентифицирован в 29,2% случаев и встречался только у Klebsiella pneumoniae. Blatem+blactx-М-1 детектирован в 20,8%, а blactx-М-1+blashv+blatem — в 12%.
Не удалось определить генетические детерминанты резистентности у одного штамма Escherichia coli и Enterobacter cloacae. Однокрано детектирован ген blactx-М-1 у Escherichia coli, blatem — у Escherichia coli и Proteus mirabilis. Обращает на себя внимание обнаруженное в ходе локального микробиологического мониторинга носительство карбапенемазу продуцирующего штамма Escherichia coli (blactx-М-1+blaNDM), устойчивого к карбапенемам, антибиотикам группы резерва. Отсутствие штамма с аналогичной фенотипической характеристикой в образцах биологического материала и смывах с объектов окружающей среды в течение шестимесячного периода до и после даты обнаружения карбапенемазы продуцирующего изолята позволяет с высокой долей вероятности предполагать о том, что выявленный штамм внебольничного происхождения, который не включился в циркуляцию госпитальных штаммов во внутрибольничной среде.
На рисунке 2 представлен спектр генетических детерминант антибиотикорезистентности, установленный при исследовании штаммов, выделенных от женщин.
Среди представителей семейства Enterobacteriaceae, выделенных от женщин, геновариант blactx-М-1 встречался в 37,2% случаев и был выявлен только у Escherichia coli. А варианты blactx-М-1+blatem и blactx-М-1+blashv — в 16,3%.
В результате проведенного исследования установлено, что в 2024г., как и в 2021, 2022 г.г. доминирующим геном, остается blaCTX-M-1 [7][8].
Обсуждение.
Наличие штаммов без выявленных детерминант антибиотикорезистентности используемыми диагностическими подходами подтверждает реализацию иных механизмов формирования антибиотикорезистентности, таких как работу эффлюксных насосов, изменение структуры транспортных каналов, формирование метаболического шунта и изменение мишени для действия антибиотика.
Доминирование геноварианта blactx-М-1
среди энтеробактерий, выделенных от женщин, обусловлено преобладанием БЛРС-продуцирующих штаммов Escherichia coli.
В 2024 г впервые за 7 лет проводимых нами исследований по выявлению генетических детерминант антибиотикорезистентности выявлен штамм Escherichia coli с множественной лекарственной устойчивостью, обладающий геном blaNDM. Аналогичный ген был детектирован в 2022, но в штамме K. pneumoniae, колонизирующем кищечный биотоп новорожденного ребенка, что подтверждает распространение антибиотикорезистентных штаммов в человеческой популяции.
Также обращает на себя внимание выявление K. pneumoniae с генетическим профилем антибиотикорезистентности blatem, blactx-М-1, blashv, blaoxa-48-like, blaNDM.
Полученные в ходе настоящего исследования результаты свидетельствуют о возможной колонизации кишечника новорожденных детей в период их нахождения на стационарном этапе выхаживания штаммами энтеробактерий с множественной лекарственной устойчивостью, ассоциированной с несколькими генетическими детерминантами антибиотикорезистентности. Что способствует формированию так называемого депо устойчивых к действию антибиотиков штаммов условно-патогенных микроорганизмов и пребыванию во внутрибольничной среде источников возбудителей инфекционных заболеваний [9-11].
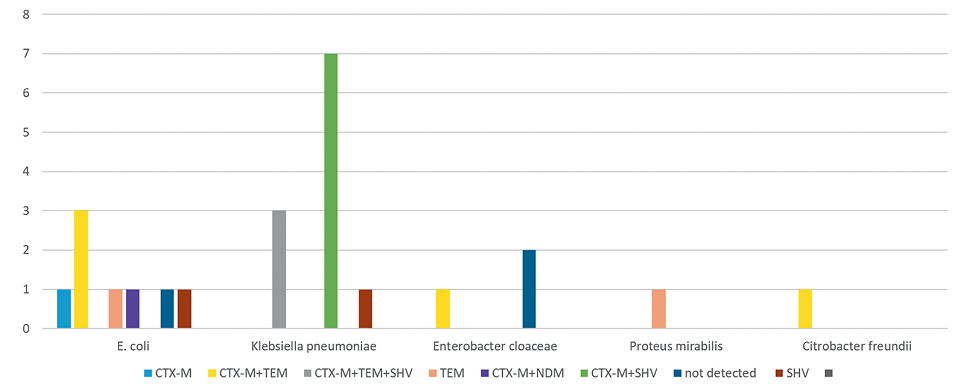
Рисунок 1. Генетический профиль антибиотикорезистентности БЛРС-продуцирующих штаммов, выделенных от детей.
Figure 1. Genetic profile of antibiotic resistance of ESBL-producing strains isolated from children.
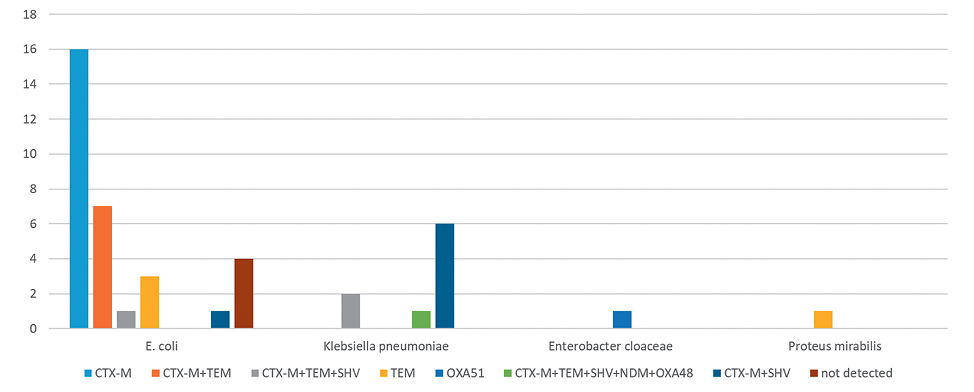
Рисунок 2. Генетический профиль антибиотикорезистентности БЛРС-продуцирующих штаммов, выделенных от женщин.
Figure 2. Genetic profile of antibiotic resistance of ESBL-producing strains isolated from women.
Заключение
Таким образом, генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического отделений представлен 8-ю геновариантами, в которых доминирующим геном, обеспечивающим устойчивость к бета лактамным антибиотикам среди представителей энтеробактерий в 2024г, как и в 2021, 2022 гг., остается blaCTX-M-1, который обнаруживается как в моноварианте, так и в ассоциации с blatem и blashv.
Список литературы
1. Meropol S.B., Stange K.C., Jacobs M.R., Weiss J.K., Bajaksouzian S., Bonomo R.A. Bacterial Colonization and Antibiotic Resistance in a Prospective Cohort of Newborn Infants During the First Year of Life. Open Forum Infect Dis. 2016 Dec 5;3(4):ofw221. https://doi.org/10.1093/ofid/ofw221
2. Li W., Tapiainen T., Brinkac L., Lorenzi H.A., Moncera K., Tejesvi M.V., Salo J., Nelson K.E. Vertical Transmission of Gut Microbiome and Antimicrobial Resistance Genes in Infants Exposed to Antibiotics at Birth. J Infect Dis. 2021 Oct 13;224(7):1236-1246. https://doi.org/10.1093/infdis/jiaa155
3. Тимофеева О.Г., Поликарпова С.В. Локальный микробиологический мониторинг штаммов Enterobacterales, продуцирующих карбапенемазы. Лабораторная служба. 2019; 8 (3):1419. https://doi.org/10.17116/labs2019803114
4. Gu S., Lai J., Kang W., Li Y., Zhu X., Ji T., Feng J., Zhao L., Li Z., Dong L., Hou G., Zhu Y., Li Z., He C., Geng H., Pang D., Wang Y. Drug resistance characteristics and molecular typing of Escherichia coli isolates from neonates in class A tertiary hospitals: A multicentre study across China. J Infect. 2022 Nov;85(5):499-506. https://doi.org/10.1016/j.jinf.2022.09.014
5. Белов А. В., Пырегов А. В., Трошин П. В. [и др.]. Современное состояние проблемы и клиническое наблюдение терапии акушерского сепсиса, вызванного ESKAPE-патогенами. Акушерство и гинекология. 2022;4: 164-175. https://doi.org/10.18565/aig.2022.4.164-175
6. Сердюкова Д. М., Шабанова Н. Е., Любасовская Л. А. [и др.] Современное состояние антибиотикорезистентности оппортунистических патогенов и уровня потребления антибактериальных препаратов в акушерском стационаре федерального значения третьего уровня. Антибиотики и химиотерапия. 2019; 64(11-12):39-47. https://doi.org/10.1016/0235-2990-2019-64-11-12-39-47
7. Устюжанин А. В., Чистякова Г. Н., Ремизова И. И., Маханек А. А. Распространенность генов антибиотикорезистентности bla-CTX-M, bla-SHV, bla-TEM в штаммах энтеробактерий, выделенных от пациентов перинатального центра Эпидемиология и вакцинопрофилактика. 2022;21(3):44-49. https://doi.org/10.31631/2073-3046-2022-21-3-44-49
8. Устюжанин А. В., Чистякова Г. Н., Ремизова И. И., Маханек А. А. Генетические детерминанты антибиотикорезистентности энтеробактерий, выделенныхв ходе микробиологического мониторинга в перинатальном центре Эпидемиология и вакцинопрофилактика. 2023;22(4):49-55. https://doi.org/10.31631/2073-3046-2023-22-4-49-55
9. Точилина А. Г., Соловьева И. В., Белова И. В. [и др.] Опыт использования MALDI TOF минисеквенирования для исследования бета-лактамаз типа ТЕМ штаммов K. pneumoniae, циркулирующих в педиатрических стационарах. Журнал МедиАль. 2020;2(26):18-23. https://doi.org/10.21145/2225-0026-2020-2-18-23
10. Белова И. В., Точилина А. Г., Соловьева И. В. [и др.] Характеристика госпитальных штаммов Klebsiella pneumoniae, циркулирующих в педиатрическом стационаре. Здоровье населения и среда обитания - ЗНиСО. 2019; 8(317):25-29. https://doi.org/10.35627/2219-5238/2019-317-8-25-29
11. Гординская Н. А., Борискина Е. В., Кряжев Д. В. Фенотипические и молекулярно-генетические особенности антибиотикорезистентности клинических изолятов Klebsiella pneumoniae в стационарах Нижнего Новгорода Клиническая микробиология и антимикробная химиотерапия. 2022;3: 268-272. https://doi.org/10.36488/cmac.2022.3.268-272.
Об авторах
А. В. УстюжанинРоссия
Устюжанин Александр Владимирович — к.м.н., ведущий научный сотрудник научного отделения иммунологии, микробиологии, патоморфологии и цитодиагностики
ул. Репина, д. 1, г. Екатеринбург, 620028
Г. Н. Чистякова
Россия
Чистякова Гузель Нуховна — доктор медицинских наук, профессор, заслуженный деятель науки РФ, руководитель научного отдела микробиологии, иммунологии, патоморфологии и цитодиагностики
ул. Репина, д. 1, г. Екатеринбург, 620028
И. И. Ремизова
Россия
Ремизова Ирина Ивановна — к.б.н.
ул. Репина, д. 1, г. Екатеринбург, 620028
Рецензия
Для цитирования:
Устюжанин А.В., Чистякова Г.Н., Ремизова И.И. Генетический профиль антибиотикорезистентности штаммов энтеробактерий, выделенных от пациентов акушерско-гинекологического и педиатрического профилей. Вестник охраны материнства и младенчества. 2024;1(3):72-79. https://doi.org/10.69964/BMCC-2024-1-3-72-79
For citation:
Ustyuzhanin A.V., Chistyakova G.N., Remizova I.I. Genetic profile of antibiotic resistance of enterobacteria strains isolated from obstetrics, gynecology and pediatric patients. Bulletin of maternal and child care. 2024;1(3):72-79. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-3-72-79









