Перейти к:
Микробиом беременности (обзор литературы)
https://doi.org/10.69964/BMCC-2024-1-3-25-41
Аннотация
Введение. Беременность представляет собой уникальный иммунологический и физиологический период, в течение которого микробные сообщества могут оказывать значительное влияние как на здоровье матери, так и на исход родов. Гормональные, иммунологические и метаболические изменения во время беременности влияют на микробиом и клинические результаты, потенциально сказываясь на благополучии матери и ребёнка.
Цель. Обобщение современных научных представлений о связи состава микробиоты матери при беременности и ее осложнениях, обсуждение возможности прогнозирования осложнений беременности с использованием микробиома.
Материалы и методы. Был проведён обзор литературы с использованием базы данных MEDLINE (PubMed) по состоянию на декабрь 2024 года с использованием ключевых слов и фильтра: рандомизированное контролируемое исследование, метаанализ, систематический обзор.
Результаты. Обширные исследования связывают доминирование определенных штаммов Lactobacillus с различными исходами беременности, при этом L. cripatus является наиболее благоприятным штаммом. Лишь существуя в нормальных симбиотических взаимоотношениях организм–микробиом, возможно поддержание гомеостаза. Любое смещение баланса в этой системе приводит к росту условно-патогенной флоры, что, в свою очередь, запускает каскад иммунологических, физиологических нарушений. ГСД, СПЯ, преждевременные роды — эти состояния — имеют особенности вагинального микробиоценоза.
Заключение. Подробное изучение микробиоты беременных и родильниц, процесса передачи микроорганизмов от матери к ребенку даст нам возможность выявления предикторов патологических процессов в периоде беременности, раннем и позднем послеродовом периодах, периоде новорожденности, а также послужит субстратом для выявления групп риска и создания алгоритмов обследования, предотвращения инфекционно-воспалительных осложнений у беременных, родильниц и новорожденных.
Для цитирования:
Данькова И.В., Дерябина Е.Г., Маликова М.А. Микробиом беременности (обзор литературы). Вестник охраны материнства и младенчества. 2024;1(3):25-41. https://doi.org/10.69964/BMCC-2024-1-3-25-41
For citation:
Dankova I.V., Deryabina E.G., Malikova M.A. Microbiome of pregnancy (literature review). Bulletin of maternal and child care. 2024;1(3):25-41. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-3-25-41
Введение
Микробиом человека, включающий триллионы микроорганизмов, находящихся на теле человека и внутри него, стал критическим фактором, влияющим на различные аспекты здоровья человека [1]. Он состоит из бактерий, вирусов, грибков, архей и других микробных образований, которые образуют сложные экосистемы в различных участках тела. Микробиом был тщательно изучен в кишечнике, коже и полости рта, что демонстрирует его глубокое влияние на метаболические процессы, иммунную регуляцию и патогенез заболеваний. Однако также было показано, что микробиом может быть вовлечен в репродуктивное здоровье, включая фертильность, исходы беременности и гинекологические расстройства [2].
Каждое микробное сообщество играет уникальную роль в репродуктивном здоровье и может влиять на исходы беременности. Микробиом влагалища играет решающую роль в репродуктивном здоровье и хорошо изучен из-за возможности легкого взятия проб. Его состав и стабильность влияют на pH влагалища, иммунные реакции и восприимчивость к инфекциям. Дисбиоз влагалища связан с неблагоприятными репродуктивными исходами, включая потерю беременности [3][4].
Целью этого обзора явилось обобщение современных научных представлений о связи состава микробиоты женщины с ее репродуктивным здоровьем и обсуждение возможности влияния на перинатальный исход с использованием микробиома.
Материалы и методы
Был проведён обзор литературы с использованием базы данных MEDLINE (PubMed) по состоянию на ноябрь 2024 года с использованием ключевых слов: «беременность», «микробиом», «микробиота» и фильтра: рандомизированное контролируемое исследование, метаанализ, систематический обзор. Дополнительные ресурсы были определены с использованием списков литературы полученных статей.
Эндометриальный микробиом
Эндометриальный микробиом относится к разнообразным микробным сообществам внутри матки. Хотя эндометрий традиционно считался стерильной средой, достижения в области молекулярных методов выявили динамичную и сложную микробную экосистему внутри эндометрия [5]. Хотя остаются методологические препятствия для определения эндометриального микробиома из-за очень низкой биомассы и трудностей с загрязнением человеческой ДНК, дисбиоз эндометриального микробиома был связан с ухудшением результатов ЭКО и (повторной) потерей беременности [6-8]. В исследовании Морено и соавторов (2022) было обнаружено, что присутствие микробиоты, не содержащей Lactobacillus, в рецептивном эндометрии было связано со значительным снижением показателей имплантации [ 60,7% против 23,1% (p = 0,02)], беременности [ 70,6% против 33,3% (p = 0,03)], продолжающейся беременности [ 58,8% против 13,3% (p = 0,02)] и живорождения [ 58,8% против 6,7% (p = 0,002)] по сравнению с микробиотой, в которой доминируют Lactobacilli. В исследовании Морено и соавторы (2022) выявили, что Atopobium Bifidobacterium, Chryseobacterium, Gardnerella, Haemophilus, Klebsiella, Neisseria, Staphylococcus и Streptococcus были обнаружены у женщин с репродуктивной недостаточностью, тогда как доминирующее присутствие Lactobacillus было отмечено у пациенток, которые родили живого ребенка. Отдельным вопросом является высокая вероятность контаминации образцов эндометриального микробиоценоза. При отборе проб эндометрия практически невозможно избежать цервико-вагинального заражения в случаях, когда отбор проб осуществляется через шейку матки.
Эндометриоз, хронический эндометрит, дисфункциональное эндометриальное кровотечение, злокачественное новообразование или гиперплазия эндометрия и плохие результаты вспомогательных репродуктивных технологий (ВРТ) были связаны с измененным составом микробиома эндометрия [7][8].
Образцы эндометрия женщин после гистерэктомии, были исследованы методом ПЦР, что позволило описать микробиом верхнего отдела влагалища, при этом наиболее распространенными видами были Liners, Prevotella spp и L crispatus. С помощью секвенирования 16S рРНК был исследован микробиом матки (эндометриальная жидкость) и влагалища (аспират) у 13 фертильных женщин. Было показано, что Lactobacillus spp. был преобладающим видом в эндометриальной жидкости фертильных здоровых женщин. Gardnerella, Bifidobacterium, Streptococcus и Prevotella были среди других наиболее распространенных видов. Кроме того, они показали, что у 35 бесплодных женщин наличие эндометриального микробиома, в котором доминируют не Lactobacillus (<90% Lactobacillus spp.), было связано со значительно более низкими шансами имплантации и живорождения. Однако следует отметить, что даже несмотря на то, что они идентифицировали таксоны в эндометрии, которые не присутствовали в образцах влагалища и наоборот, статистическое сравнение не доказало существенной разницы между эндометриальным и вагинальным микробиомом, что ставит под сомнение фактическое существование эндометриального микробиома. Эти результаты были повторены в следующем международном многоцентровом исследовании той же группы, в котором анализировалась эндометриальная жидкость и биопсии у 342 пациенток. Напротив, в исследованиях, где биопсия эндометрия проводилась при гистерэктомии [8][9] или лапароскопии [8] (тем самым снижая риск кантаминации) получены данные, что Lactobacillus не доминирует в полости матки. Вместо этого такие бактерии, как Pseudomonas, Acinetobacter, Vagococcus и Sphinogobium, вносят наибольший вклад в микробиом эндометрия. Тем не менее, показания к гистерэктомии или лапароскопии включали наличие миомы матки, дисфункционального кровотечения и гиперплазии эндометрия, а пациенты были значительно старше, чем в исследованиях, включающих бесплодные пары. Эти различия делают сравнение этих исследований практически невозможным. Это подчеркивает уникальные проблемы при анализе микробиома эндометрия с низкой биомассой по сравнению с другими участками тела [10][11]. Низкая микробная биомасса затрудняет получение достаточного количества микробной ДНК для анализа. В этом заключается риск заражения во время взятия образцов эндометрия: необходимо соблюдать меры предосторожности во время сбора образцов, чтобы свести к минимуму загрязнение от вагинальной или цервикальной микробиоты, которые более доступны. Поэтому соответствующие контроли имеют решающее значение в исследованиях микробиома эндометрия, чтобы дифференцировать фактическую микробиоту эндометрия от загрязнителей. Контроли должны включать отрицательные контроли, которые улавливают любое фоновое загрязнение во время обработки образцов, и положительные контроли, которые проверяют эффективность и чувствительность методов секвенирования и анализа. Поэтому на данный момент тестирование микробиома эндометрия не может использоваться в стандартных клинических условиях, но представляется важным к изучению, особенно при ведении пациентов с привычным невынашиванием, хроническим эндометритом, бесплодием, неэффективными попытками вспомогательных репродуктивных технологий.
Китайское исследование наблюдало за включенными в него пациентками с ПНБ в течение 14 месяцев после биопсии эндометрия [7]. Авторы смогли показать, что пациентки с увеличением Ureplasma spp. имели более высокий риск преждевременных родов и потери беременности, чем пациентки, у которых не было повышенного уровня уреаплазмы.
Вагинальный микробиоценоз
В оптимальном состоянии вагинальный микробиоценоз состоит из Lactobacillus spp., которые вырабатывают молочную кислоту, перекись водорода и бактериоцины, и вместе образуют кислую среду, которая подавляет пролиферацию других видов бактерий [10]. Состав и стабильность вагинального микробиоценоза могут различаться у разных людей, не являются статичными и могут подвергаться сильным колебаниям, иногда ежедневным. Это связано с множеством факторов: незащищенный половой акт, гормональные изменения во время менструального цикла, беременность или некоторые лекарства, такие как антибиотики [11].
Вагинальный дисбиоз связан с несколькими неблагоприятными репродуктивными исходами, которые варьируются от идиопатического бесплодия и преждевременных родов, инфекций, передающихся половым путем, и даже гинекологических злокачественных новообразований [7].
При секвенировании 16S рРНК выделены пять основных видов: с доминированием Lactobacillus crispatus (CST I), с доминированием Lactobacillus gasseri (CST II), с доминированием Lactobacillus iners (CST III), с доминированием Lactobacillus jensenii (CST V) и с доминированием различных анаэробов (CST IV) [12]. Поскольку такая упрощенная классификация часто упрощает научный анализ, она была пересмотрена в 2020 году, снова на основе данных 16srRNA, дополнительно уточнив до 13 категорий. Только недавно на основе метагеномного секвенирования были введены 27 метагеномных CST [12]. Хотя эти классификации обеспечивают большую научную детализацию, они могут показаться ошеломляющими для заинтересованного клинициста. Чтобы глубже понять вагинальный микробиом, мы здесь сосредоточимся на пяти основных CST: CST I и CST II характеризуются высоким содержанием видов Lactobacillus, в частности Lactobacillus crispatus и Lactobacillus gasseri. Эти лактобациллы вырабатывают молочную кислоту, создавая кислую среду, которая помогает поддерживать pH влагалища на уровне около 4,5, что подавляет рост потенциальных патогенов. Lactobacillus crispatus вырабатывает больше всего молочной кислоты и поэтому имеет самый низкий pH влагалища из всех CST. Женщины с CST I или CST II часто считаются имеющими «здоровый» микробиом влагалища, поскольку вагинальная микробиота с преобладанием Lactobacillus связана с успешными (репродуктивными) исходами [12].
CST III отличается доминированием Lactobacillus iners, которая более изменчива по своей кислотопродуцирующей способности, чем другие виды Lactobacillus. L. iners имеет самую низкую способность к образованию молочной кислоты, поскольку она преобразует глюкозу только через пируват в L-лактат, а не в D-лактат, что приводит к более высокому pH, чем у женщин из других групп с преобладанием Lactobacillus. Хотя CST III является распространенным и не обязательно указывает на нездоровое состояние, его связывают с повышенным риском бактериального вагиноза (БВ) и других вагинальных инфекций.
CST IV представляет собой разнообразное микробное сообщество с повышенным содержанием анаэробных бактерий, включая Gardnerella vaginalis, Fannyhessia vaginae, Prevotella spp. и другие. Этот CST связан с более высоким риском БВ и других гинекологических заболеваний, таких как инфекции, передающиеся половым путем, и преждевременные роды. Переход от CST с преобладанием Lactobacillus к CST IV часто сопровождается повышением pH влагалища и нарушением тонкого баланса вагинальной экосистемы [12].
CST V характеризуется доминированием Lactobacillus jensenii. Он считается переходным состоянием между CST, в которых доминируют Lactobacillus, и CST IV. Значимость CST V с точки зрения результатов вагинального здоровья еще не полностью изучена, и необходимы дальнейшие исследования для выяснения его роли.
Используя световую микроскопию и бактериальную культуру, было установлено, что у женщин с привычным невынашиванием (ПНБ) распространенность аэробного вагинита в пять раз выше, чем у здоровых лиц контрольной группы [4]. В другом исследовании при использовании секвенирования 16S рРНК и здоровых лиц контрольной группы наблюдалась повышенная распространенность рода Atopobium у пациенток с ПНБ [7, 12]. Atopobiaceae — это семейство бактерий, которое включает вид Fannyhessea vaginae. Эта грамположительная коккобацилла может быть идентифицирована у более чем 80% пациенток с бактериальным вагинозом. Исследование также отметило более высокую распространенность Prevotella, рода грамотрицательных анаэробных бактерий. Вместе с Gardnerella vaginalis, как Fannyhessea vaginae, так и Prevotella являются одними из наиболее часто встречающихся видов бактерий при бактериальном вагинозе, который связан с другими неблагоприятными исходами беременности. Более того, Streptococcus, разнообразный род грамположительных бактерий с видами, которые включают комменсальные и патогенные организмы, был обнаружен в большем количестве у пациенток с ПНБ. В исследованиях пациенток с ПНБ была описана повышенная распространенность Pseudomonas и Proteobacteria [13]. Отдельно было сообщено об уменьшении микробного богатства у пациенток с ПНБ. Интересно, что также наблюдалось повышенное обилие Megasphaera и Sneathia sanguinegens, бактерий, связанных с преждевременными родами и хориоамнионитом [14], что подтверждает идею о том, что дисбаланс в микробных сообществах может влиять на исходы беременности. В контрольной группе наблюдалась более высокая распространенность Lactobacillus iners (контролем были здоровые женщин с предыдущими живорождениями). Известно, что Lactobacillus iners более распространена среди женщин, которые рожали, что может объяснить эти различия и подчеркивает важность четко определенного контроля в исследованиях, посвященных ПНБ. Хотя многие из этих исследований указывают на более высокое разнообразие у пациенток с ПНБ, указывая на то, что измененная микробиота влагалища способствует ПНБ, не все исследования выявили различия между пациентками с ПНБ и контрольной группой [13-16]. В исследовании, проведенном с наблюдением за пациентками во время последующей беременности, не было никакой разницы в процентном содержании Lactobacillus или разнообразии бактерий во влагалище между пациентками, у которых было живорождение, и теми, у кого произошел выкидыш. Однако взятие проб из шейки матки показало, что Cutibacterium и Anaerobacillus были значительно более распространены в шейках матки пациенток, у которых была эуплоидная потеря беременности, по сравнению с теми, у кого было живорождение. На сегодняшний день крупнейшее исследование микробиома влагалища и спонтанной потери беременности включало 93 потери беременности и обнаружило, что эуплоидная потеря беременности связана с дисбактериозом влагалища [17]. Выборка проводилась среди беременных женщин и была больше сосредоточена на спорадических потерях, чем на ПНБ. Тем не менее, у включенных пациенток с ПНБ (≥ 3 потерь) не было выявлено никакой связи между потерями и дисбактериозом, что, возможно, указывает на то, что ПНБ не всегда представляет собой эуплоидную потерю беременности или что дисбактериоз является лишь одной из нескольких потенциальных причин невынашивания беременности в этой гетерогенной популяции пациенток — или просто на то, что настоящее исследование не имеет статистической мощности.
Подводя итог, эти результаты подчеркивают тонкую роль, которую микробиом играет в ПНБ. Некоторые бактериальные таксоны, включая Fannyhessea vaginae, Prevotella и Streptococcus, обнаруживаются в более высокой распространенности у пациентов с ПНБ, в то время как другие, такие как Lactobacillus, показывают неоднозначные результаты. Непоследовательные наблюдения в микробном разнообразии и распространенности в разных исследованиях также подчеркивают сложность этих ассоциаций и важность строгих диагностических критериев и методологии. Необходимы дальнейшие исследования с более крупными когортами, строгими критериями относительно дней отбора проб и продольными планами, чтобы полностью понять роль вагинального микробиома в ПНБ и выяснить потенциальные терапевтические вмешательства на основе микробиома.
На фето-материнском интерфейсе в здоровом состоянии взаимодействие между бактериями и иммунными клетками включает три потенциальных механизма, которые способствуют поддержанию здорового баланса: во-первых, врожденные иммунные клетки и эпителиальные клетки продуцируют антимикробные пептиды, служащие барьерным защитным механизмом для защиты местной выстилки тканей от потенциальных инфекций [17]. Во-вторых, антиген-презентирующие клетки взаимодействуют с бактериями, вызывая иммунный ответ, характеризующийся активацией иммунных клеток, таких как естественные клетки-киллеры матки (NK), и косвенным влиянием на Т-клетки. Этот иммунный ответ вызывает сдвиг в сторону иммунного профиля Th-2, тем самым поддерживая такие важные процессы, как имплантация, ангиогенез и ремоделирование спиральных артерий [18]. В-третьих, бактериальные метаболиты вызывают локализованный иммунный ответ, усиливая вышеупомянутые механизмы. Однако в контексте дисбактериоза, когда баланс бактерий нарушается, эти механизмы становятся восприимчивыми к нарушениям. Нарушение локального барьера и эпителия делает его более уязвимым к повреждению. Это повреждение инициирует каскад сигнальных событий, которые достигают кульминации в измененном иммунном ответе, характеризующемся сдвигом в сторону ответа цитокинов Th1. Такой иммунный ответ может иметь далеко идущие последствия, влияя на ключевые процессы, такие как ангиогенез, ремоделирование спиральных артерий и функционирование NK-клеток матки, что в конечном итоге приводит к аберрантной имплантации и плацентации [17-20].
Было даже продемонстрировано, что L. crispatus способен подавлять высвобождение IL-6 и IL-8 с использованием культуры эпителиальных клеток влагалища [21][22]. Напротив, повышенное относительное обилие видов Gardnerella и Ureaplasma во влагалище, как это наблюдается при (рецидивирующей) потере беременности, было связано со сдвигом в сторону провоспалительного состояния [23]. При анализе цервиковагинальных выделений, а также вагинальной микробиоты у женщин с потерями беременности по сравнению с женщинами, рожавшими в более поздние сроки, Grewal et al. показали, что у женщин с истощенным вагинальным микробиомом Lactobacillus и потерей беременности были повышены провоспалительные цитокины IL-1β, IL-6 и TNF-α. Это согласуется с результатами у женщин, перенесших цервикальный серкляж, где истощенный микробиом Lactobacillus также был связан с воспалением [22]. Измененный иммунный профиль также может быть обнаружен у женщин с ПНБ, проходящих скрининг на Gardnerella vaginalis: распространенность Gardnerella vaginalis и грамотрицательных анаэробов у пациенток с ПНБ с повышенным уровнем периферических NK-клеток (pNK) была значительно выше по сравнению с пациентками с нормальным уровнем pNK [24].
В совокупности эти результаты подчеркивают потенциал микробиоценоза репродуктивного тракта в формировании иммунных реакций во время беременности и возможную роль микробного дисбиоза в ПНБ через его влияние на иммунный баланс. Дальнейшие исследования интерфейса микробиом-иммунитет в контексте имплантации, плацентации могут дать ценную информацию для разработки терапевтических стратегий на основе микробиоты для восстановления иммунного баланса и улучшения результатов беременности [25-27].
Микробиом кишечника
Микробиоценоз кишечника человека включает ∼100 триллионов микробных клеток, включая бактерии, вирусы, грибки и другие микроорганизмы, которые сосуществуют в нашем желудочно-кишечном тракте [28][29]. В последние годы микробиом кишечника стал критически важным фактором, определяющим здоровье и болезни человека, учитывая его разнообразные роли в питании, иммунитете и метаболизме хозяина.
Сбалансированная микробиота кишечника, в отличие от микробиоты влагалища, часто характеризующейся высокой степенью разнообразия, ассоциируется с хорошим здоровьем. При отборе проб из микробиома кишечника для анализа чаще всего используют образец кала, ректальный мазок, биопсию слизистой оболочки или кишечную жидкость, которые представляют только часть желудочно-кишечного тракта [29].
Роль микробиома кишечника выходит за рамки его общепризнанного влияния на питание, иммунитет и метаболизм хозяина, поскольку он также сильно зависит от беременности. Интересно, что беременность не только вызывает композиционные и функциональные изменения в микробиоме кишечника, но и, как было показано, изменения в микробиоме кишечника связаны с исходами беременности [29][30].
Особенности и динамика микробиоценоза кишечника во время беременности показали незначительные колебания, альфа-разнообразие микробиома кишечника уменьшалось по мере развития беременности (рис. 1, P-значение < 0,001). Микробные сообщества также различались между стадиями беременности ( рис. 1, P-значение = 0,003). Преобладающими родами в кишечнике беременных женщин были Bacteroides, Faecalibacterium и Prevotella, каждый из которых демонстрировал различные закономерности изменений (рис. 1). Например, Bacteroides уменьшался от первого ко второму триместру, причем это снижение выходило на плато в течение третьего триместра. Напротив, Prevotella испытала существенное расширение на поздних стадиях беременности (рис. 1, q-значение < 0,25). Также наблюдалось увеличение межиндивидуальных различий по мере развития беременности (рис. 1, P-значение < 0,001). Однако, поскольку в публичных исследованиях микробиома часто отсутствуют всеобъемлющие метаданные, включая подробную историю питания, основные механизмы, определяющие наблюдаемое расхождение микробиоты кишечника во время беременности, остаются областью, требующей более глубокого изучения.
Микробиом кишечника беременных женщин различается в разных странах. Особы интерес представляет исследование Alemu et. all [12]. Для изучения географических различий в микробиоме кишечника беременных сравнили образцы из Китая и США, выбранные в качестве представителей незападных и западных популяций. Альфа-разнообразие было значительно выше во время беременности у китайских женщин по сравнению с их американскими коллегами (рис. 1, P-значение < 0,001). Кроме того, были обнаружены различные траектории в микробном составе двух стран. Например, обилие Bacteroides претерпело быстрое снижение у китайских женщин, начиная со второго триместра, в то время как это снижение было более постепенным у американок (рис. 1, h). Интересно, что в течение первого триместра различия в микробиоме кишечника между двумя популяциями были относительно минимальными (рис. 1, P-значение < 0,001). Китайские женщины показали повышенные уровни Bifidobacterium, Blautia и Feacalibacterium в своей микробиоте кишечника (рис. 1, h), что было связано с улучшением здоровья матери и благоприятными исходами для потомства [30-32]. Чтобы изучить функциональные различия, было спрогнозировано функциональное изобилие с помощью PICRUSt2, что позволило обнаружить, что такие пути, как биосинтез L-изолейцина и ферментация пирувата в изобутанол, были обогащены у китайских женщин (рис. 1, P-значение < 0,001). Несмотря на то, что динамические различия наблюдались между различными популяциями, необходимы дальнейшие анализы для выяснения роли конкретных микробов и метаболитов в здоровье матери.
В отличие от микробиома кишечника, альфа-разнообразие вагинального микробиома у здоровых беременных женщин было значительно ниже. Значительные различия наблюдались между каждым триместром (рис. 2, b, тест ANOSIM, значение P = 0,001). При переходе от первого ко второму триместру наблюдались значительные колебания относительной численности большинства видов бактерий, хотя эта тенденция демонстрировала замедление по мере дальнейшего развития беременности (рис. 2, с). Например, Lactobacillus, доминирующий род в микробиоте влагалища, увеличивался с первого триместра и оставался заметно высоким в относительной численности до родов. Напротив, Shuttleworthia показала значительное снижение с началом беременности (рис. 2, c, d, q-значение < 0,25). Кроме того, различные другие виды бактерий также колебались во время беременности, достигая пика численности на разных сроках беременности (рис. 2, c, d).
Представляют интерес результаты изучения микробиоценоза при гестационном сахарном диабете (ГСД), синдроме поликистозных яичников (СПЯ), преждевременных родах, своевременных родах. (рис.3, a). Так не было обнаружено существенных различий в альфа-разнообразии между здоровыми и пациентками с ГСД как в микробиоте полости рта, так и в микробиоте кишечника ( рис. S5 a, b онлайн, двусторонний тест Вилкоксона, P -значение > 0,05).
Примечательно, что в кишечнике беременных женщин, страдающих ГСД, уровни Bacteroides были значительно выше. Кроме того, снижение численности Bacteroides течение беременности среди случаев ГСД было более постепенным по сравнению со здоровыми. Что касается микробиоты полости рта, уровни Streptococcus были значительно снижены у матерей с ГСД, в то время как Corynebacterium показали заметное увеличение. Интересно, что на разных участках тела определенные маркеры, такие как Streptococcus и Faecalibacterium, демонстрировали схожие тенденции, в то время как другие, такие как Alistipes и Bacteroides, демонстрировали изменения в противоположных направлениях [17].
Фокусирование на маркерах кишечных бактерий Bacteroides и Oscillibacter показало более значимые ассоциации с СПЯ, в то время как Subdoligranulum, Romboutisa и Fusicatenibacter играли более важную роль в возникновении ГСД ( рис. 5 d). В отличие от картины, наблюдаемой при ГСД, СПЯ показал значительно более низкое альфа-разнообразие, при этом сохраняя неразличимое бета-разнообразие в кишечнике, со значительным расширением Bacteroides. Расхождение в микробных паттернах между ГСД и СПЯ показало, что данный микроб может иметь различные роли при различных заболеваниях [17].
В исследованиях обнаружены значительные различия в микробиоте влагалища на протяжении всего срока гестации при преждевременных родах. У матерей, родивших преждевременно, было выявлено заметное увеличение альфа-разнообразия в микробиоценозе влагалища, сопровождающееся значительным снижением Lactobacillus и значительным расширением Prevotella. При изучении микробных взаимодействий у пациенток с преждевременными и своевременными родами выявлены существенные различия. Так, например, Lactobacillus отрицательно коррелировали с большинством комменсалов при преждевременных родах, сто сопровождалось значимым ростом Prevotella и Sphingomonas [17].
Таким образом, имплантация и рост эмбриона облегчаются материнской иммунной толерантностью, включающей существенные изменения в микробных сообществах, населяющих тело матери, а существенное влияние, оказываемое колебаниями женских гормонов во время беременности, выходит за рамки изолированных участков тела. Учитывая критические роли и тесную связь между микробиотой репродуктивного тракта и результатами беременности, недавние исследования все больше фокусируются на микробиоме влагалища.
Обширные исследования связывают доминирование различных штаммов Lactobacillus с различными исходами беременности, при этом L. cripatus является наиболее благоприятным штаммом.
ГСД, СПЯ, преждевременные роды — эти состояния имеют первостепенное значение для женского репродуктивного здоровья, и имеют особенности вагинального микробиоценоза. Так повышенное присутствие кишечных Bacteroides как при ГСД, так и при СПЯ, играют различную роль в двух расстройствах, подчеркивая необходимость персонализированных вмешательств, которые учитывают конкретный микробный контекст каждого осложнения. Недавнее исследование связало штамм кишечных Bacteroides с СПЯ, выяснив его влияние на уровни желчных кислот и интерлейкина-22 [17]. Наблюдения из нашего масштабного набора данных вдохновляют на дальнейшее изучение того, влияют ли штаммы Bacteroides на ГСД в связи с СПЯ.
Наиболее часто используемыми вмешательствами, направленными на микробиоту во время беременности и лактации, были пробиотики родов Lactobacillus, Bifidobacterium, Streptococcus, Saccharomyces и Anaerobes. На сегодня были исследованы пробиотики, пребиотики и синбиотики, и было обнаружено, что они демонстрируют значительную клиническую значимость в контроле гликемии у матери; метаболизме инсулина; окислительном стрессе; снижении воспалительных маркеров; лечении и профилактике лактационного мастита; облегчении симптомов тревоги; и ингибировании колонизации стрептококков группы B. В коммерчески доступных продуктах также присутствовали два рода полезных бактерий, а именно Lactobacillus и Bifidobacterium. В процессе генотипирования с помощью метода высокопроизводительного секвенирования, такого как метагеномный анализ, было выявлено, что бактерии Lactobacillus и Bifidobacterium составляли большую часть состава в продуктах [33]. Аналогичным образом, во время беременности пробиотики широко распространены среди других вмешательств, направленных на микробиоту, в основном в состав которых входят эти два доминирующих рода полезных бактерий.
Микробиотические вмешательства очень полезны для контроля гликемии у матери, метаболизма инсулина и балансировки маркеров воспалительного и окислительного стресса при гестационном диабете. Хотя их точный механизм действия на контроль гликемии неясен, установлено, что слабовыраженное хроническое воспаление и снижение маркеров окислительного стресса связаны с замедленным развитием непереносимости глюкозы, гипергликемии и гиперинсулинемии. Штаммы пробиотических бактерий, такие как Lactobacillus GG, обладают противодиабетическим действием, снижая уровень гликированного гемоглобина в крови и улучшая толерантность к глюкозе. Пробиотики также модулируют бактерии, содержащие липополисахариды, которые могут индуцировать врожденный иммунитет у эукариот, тем самым уменьшая воспаление и окислительный стресс [36].
Более того, микробиотические вмешательства эффективно снижают частоту ректовагинальной колонизации стрептококками группы B, лактационного мастита, симптомов материнской тревожности и аллергических заболеваний у младенцев. Колонизация стрептококками группы B и профилактика мастита связаны с эффектом вмешательства на микробный баланс во всем организме. Важность этих вмешательств выходит за рамки снижения частоты СГБ и снижения интранатального приема антибиотиков, что является одной из распространенных причин дисбактериоза кишечника у младенцев. Вмешательства, нацеленные на микробиоту, в основном сочетание пробиотиков и пребиотиков, также производят высокие уровни нейротрансмиттеров, нейропептидов и нейротрофических факторов, происходящих из мозга, и улучшают функции центральной нервной системы. Тем не менее, не было выявлено никакой разницы в улучшении результатов беременности и контроле гипертонии, вызванной беременностью [37].
Для младенцев вмешательства, нацеленные на микробиоту, были эффективны в ремоделировании микробиома кишечника, профилактике аллергии, включая экзему и атопический дерматит, профилактике некротизирующего энтероколита и снижении неонатальной смертности (рис. 5). Однако обзоры влияния вмешательств, нацеленных на микробиоту, на контроль гипертонии и влияние на исходы беременности, такие как профилактика преждевременных родов, не показали никакой разницы. Назначение беременным пробиотиков, пребиотиков или синбиотиков было безопасным как для матерей, так и для их младенцев. Планируются дальнейшие рандомизированные клинические исследования по влиянию микробиоты во время беременности и лактации на симптомы материнской депрессии, исходы беременности, а также профилактику и лечение преэклампсии [38-43].
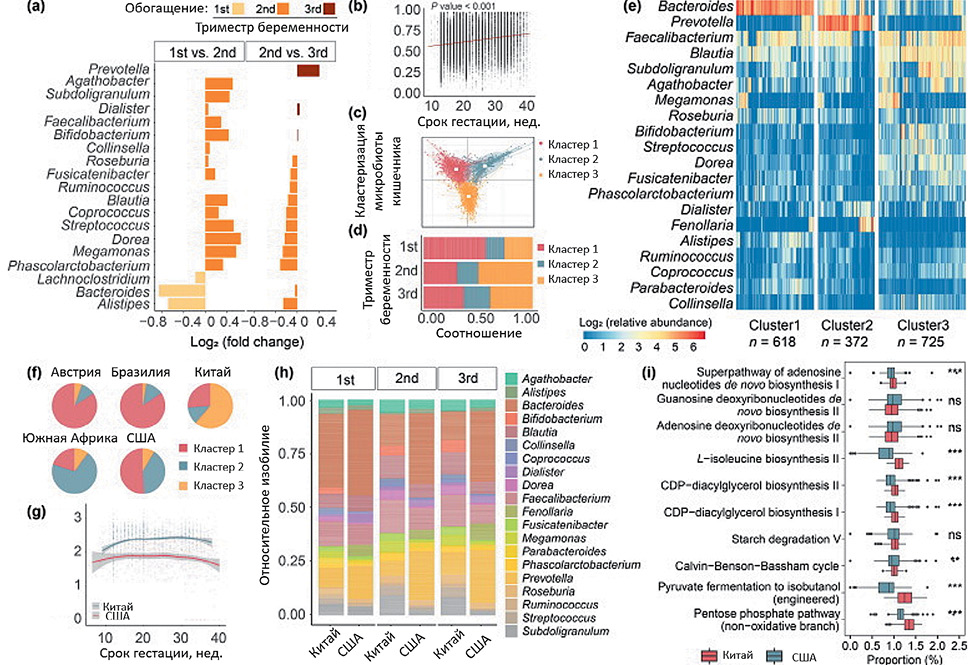
Рисунок 1. Микробиом кишечника беременных женщин различается в разных странах [17].
(a). Кратность изменений 20 основных родов кишечника во время беременности. С помощью MaAsLin2 были идентифицированы существенно различающиеся бактерии. Показаны только 20 основных бактерий со значением q < 0,25 (b). Различия между популяциями в течение беременности (c). Три микробных кластера в кишечнике беременных женщин (d). Доля трех кластеров в разных триместрах (e). Относительное обилие 20 основных родов в трех кластерах. Относительное обилие было логарифмически преобразовано для лучшей иллюстрации (f). Доля трех кластеров в разных странах (g). Изменения альфа-разнообразия в течение беременности в Китае и США (h). Относительное обилие 20 основных родов в разных триместрах в Китае и США (i)
Figure 1. The gut microbiome of pregnant women [17]
(a) Fold changes of top 20 gut genera during pregnancy. Only top 20 bacteria withq-value < 0.25 were shown. (b) Dissimilarity between populations across gestation. (c) Three microbial clusters in the gut of pregnant women. (d) Proportion of threeclusters in different trimesters. (e) Relative abundance of top 20 genera in threeclusters. Relative abundance was log transformed for better illustration. (f)Proportion of three clusters in different countries. (g) Alpha diversity changesacross gestation in China and the USA. (h) Relative abundance of top 20 genera indifferent trimesters in China and the USA. (i) Top 10 significantly differentpathways between China and the USA. ns, P-value > 0.05; *P-value < 0.05, **P-value < 0.01, ***P-value < 0.001 [17]
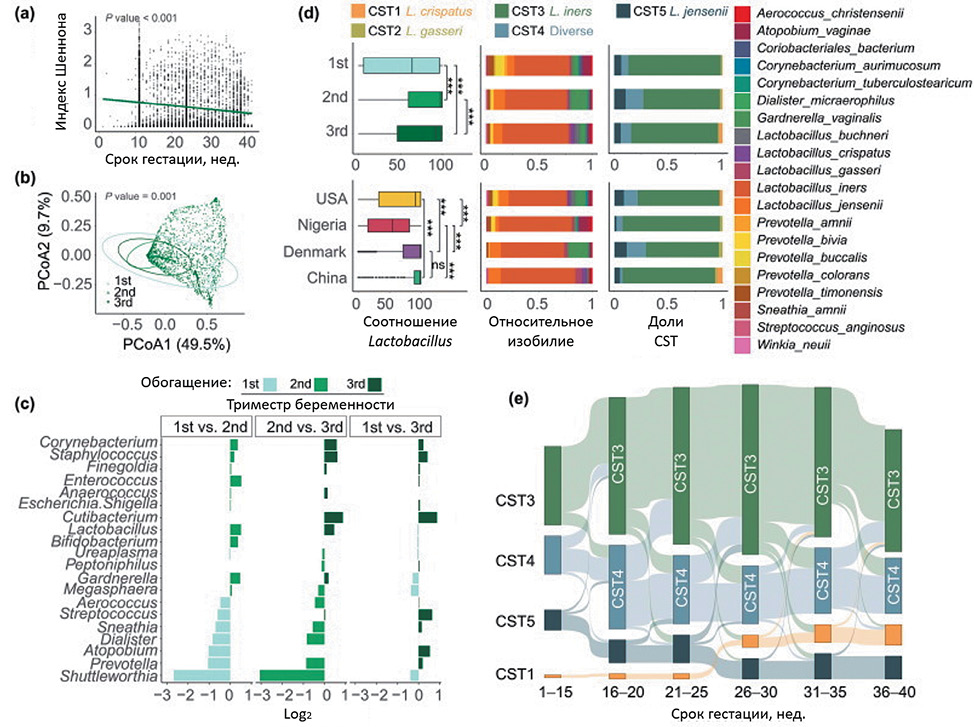
Рисунок 2. Изменения в микробиоме влагалища во время беременности [17].
(a) Изменения альфа-разнообразия в бактериальном сообществе влагалища в течение беременности (b). PCoA микробиоты влагалища в течение триместров (c). Кратные изменения 20 основных родов во влагалище во время беременности. Значительно отличающиеся бактерии были идентифицированы с помощью MaAsLin2. Показаны только 20 основных бактерий со значением q < 0,25 (d). Микробные характеристики влагалища в течение триместров и стран. Левая панель, соотношение Lactobacillus; средняя панель, относительное обилие 20 основных видов; правая панель, доля пяти CST (e). Переходы CST у отдельных лиц в течение беременности. P-значение > 0,05; * P-значение < 0,05, ** P-значение < 0,01, *** P-значение < 0,001. CST: тип состояния сообщества
Figure 2. Changes in the vaginal microbiome during pregnancy [17]
(а) Changes of alpha diversity in the vagina bacterial community across gestation.(b) PCoA of vagina microbiota across trimesters. (c) Fold changes of top 20 generain the vagina during pregnancy. Significantly different bacteria were identifiedusing MaAsLin2. Only top 20 bacteria with q-value < 0.25 were shown. (d)Microbial features in the vagina across trimesters and countries. The left panel, theratio of Lactobacillus; the middle panel, relative abundance of top 20 species; theright panel, the proportion of five CSTs. (e) CST transitions within individuals overpregnancy. ns, P-value > 0.05; *P-value < 0.05, **P-value < 0.01, ***P-value <0.001. CST: community state type [17].
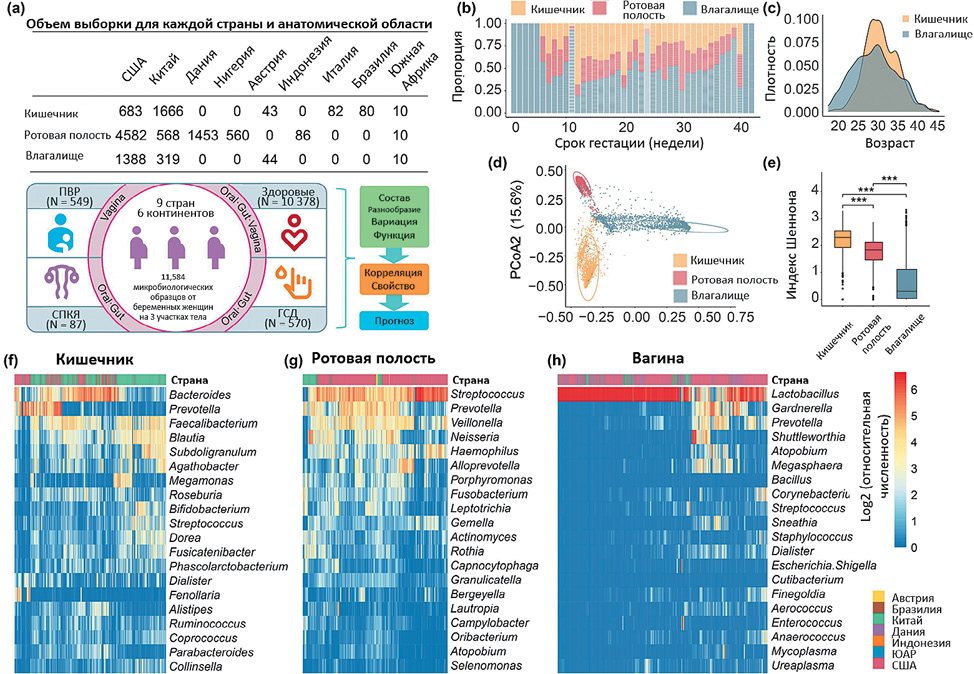
Рисунок 3. Обзор микробных характеристик в разных участках тела во время беременности [17].
(a). Обзор наборов данных, интегрированных в это исследование (b). Распределение выборки по неделям беременности (c). Распределение возраста матери в наборах данных. Отображаются только наборы данных с доступными метаданным. (d). PCoA микробиоты из трех участков тела (e). Альфа-разнообразие микробного сообщества из трех участков тела (f–h). Относительное обилие 20 основных родов в кишечнике (f), полости рта (g) и влагалище (h). Относительное обилие было логарифмически преобразовано для лучшей иллюстрации. P-значение > 0,05, * P-значение < 0,05, ** P-значение < 0,01, *** P-значение < 0,001. ГСД: гестационный сахарный диабет; СПКЯ: синдром поликистозных яичников; ПВР: преждевременные роды [17].
Figure 3. Overview of microbial characteristics across different body sites duringpregnancy [17]
(a) Overview of datasets integrated in this study. (b) Sample distribution acrossgestational weeks. (c) Distribution of maternal age in the datasets. Only thedatasets with available metadata are displayed. (d) PCoA of microbiota from threebody sites. (e). Alpha diversity of microbial community from three body sites. (f–h) Relative abundance of top 20 genera in the gut (f), oral cavity (g) and vagina(h). Relative abundance was log transformed for better illustration. ns, P-value >0.05, *P-value < 0.05, **P-value < 0.01, ***P-value < 0.001. GDM: gestationaldiabetes mellitus; PCOS: polycystic ovary syndrome; PTB: preterm birth [17].
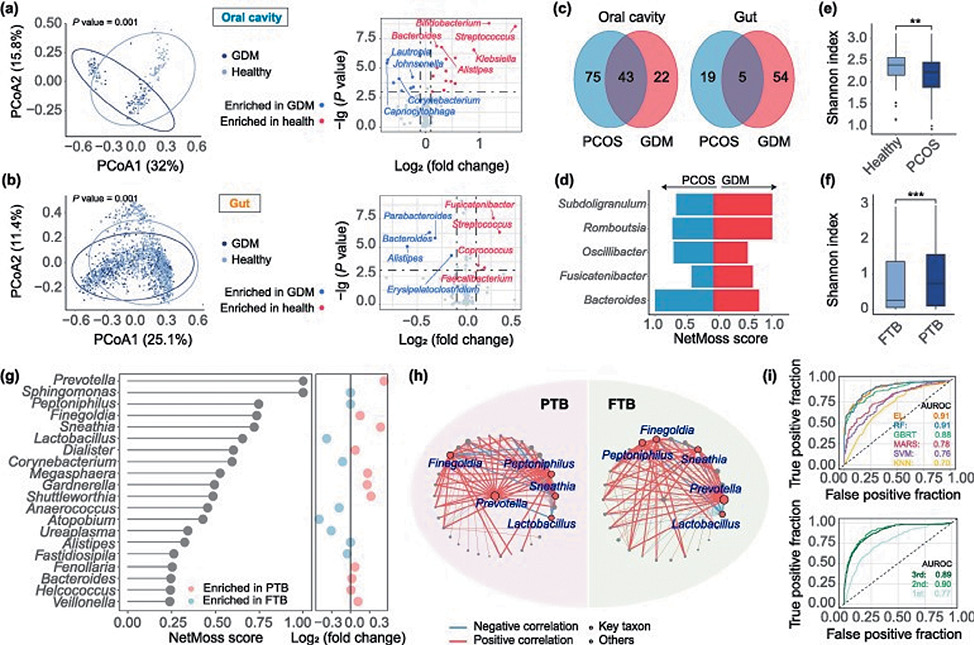
Рисунок 4. Изменения микробиома при различных осложнениях беременности [17]
(a, b) Изменение микробиоты полости рта (a) и кишечника (b) при ГСД. Левая панель, PCoA микробиоты между здоровыми и больными популяциями; правая панель, значимые бактерии с пороговым значением P <0,001 и log 2 (кратное изменение) >0,1 или < −0,1. (c) Общие биомаркеры между СПЯ и ГСД в полости рта (слева) и кишечнике (справа). Биомаркеры были идентифицированы с помощью сетевого алгоритма NetMoss. (d) Оценка NetMoss общих маркеров в кишечнике. (e, f). Альфа-разнообразие для СПЯ (e) и PTB (f) по сравнению со здоровыми популяциями. (g) Оценка NetMoss и кратные изменения между популяциями PTB и FTB. (h) Микробные сети для PTB и FTB. (i) Прогностическая способность классификации PTB и FTB на основе различных алгоритмов или различных наборов данных. Верхняя панель, классификация, основанная на всех данных с использованием различных стратегий; нижняя панель, классификация, основанная на обучающих наборах данных из различных триместров с использованием ансамблевого обучения. ns, P-значение >0,05; * P-значение < 0,0,5, ** P-значение < 0,01, *** P-значение < 0,001. EL: ансамблевое обучение; FTB: доношенные роды; GBRT: дерево регрессии с градиентным усилением; GDM: гестационный сахарный диабет; KNN: k-ближайшие соседи; MARS: многомерные адаптивные регрессионные сплайны; PCOS: синдром поликистозных яичников; PTB: преждевременные роды; RF: случайный лес; SVM: машина опорных векторов.
Figure 4. The deviation of microbiome in different pregnant complications [17]
(a, b) Variation of oral (a) and gut (b) microbiota in GDM. The left panel, PCoA of microbiota between healthy and diseased populations; the right panel, significant bacteria with a threshold of P-value < 0.001 and log2 (fold change) > 0.1 or < −0.1. (c) Shared biomarkers between PCOS and GDM in oral cavity (left) and gut (right). The biomarkers were identified using a network-based algorithm NetMoss. (d) The NetMoss score of shared markers in the gut. (e, f). Alpha diversity for PCOS (e) and PTB (f) versus healthy populations. (g) The NetMoss score and fold changes between PTB and FTB populations. (h) Microbial networks for PTB and FTB. (i) Prediction power in the classification of PTB and FTB based on different algorithms or different datasets. The top panel, classification based on all data using different strategies; the bottom panel, classification based on training datasets from different trimesters using ensemble learning. ns, P-value > 0.05; *P-value < 0.0.5, **P-value < 0.01, ***P-value < 0.001. EL: ensemble learning; FTB: full-term birth; GBRT: gradient boosting regression tree; GDM: gestational diabetes mellitus; KNN: k-nearest neighbors; MARS: multivariate adaptive regression splines; PCOS: polycystic ovary syndrome; PTB: preterm birth; RF: random forest; SVM: support vector machine.
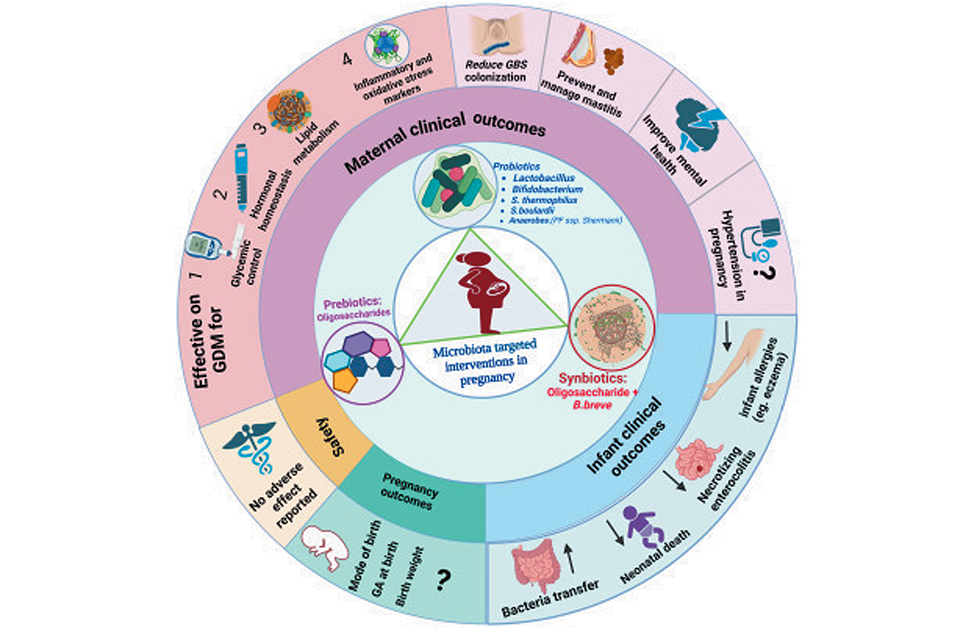
Рисунок 5. Распространенные вмешательства, направленные на микробиоту во время беременности и их влияние на различные категории результатов (клинические результаты для матери и ребенка, перенос микробиома, исходы беременности и безопасность) [33-35]
Figure 5. Common microbiota-targeted interventions during pregnancy and their impact on different outcome categories (maternal and infant clinical outcomes, microbiome transfer, pregnancy outcomes, and safety) [33-35]
Заключение
Анализ литературы показал, что микробиомный состав динамичен и подвержен влиянию ряда факторов. Лишь существуя в нормальных симбиотических взаимоотношениях организм–микробиом, возможно поддержание гомеостаза. Нерушимость этой диады доказана рядом исследований, и любое смещение баланса в этой системе приводит к росту условно-патогенной флоры, что, в свою очередь, запускает каскад иммунологических, физиологических нарушений. Все больше данных свидетельствует о том, что дисбиоз связан с различными неблагоприятными исходами беременности, такими как повышенный риск послеабортной инфекции, ранний и поздний выкидыш, хориоамнионит, послеродовой эндометрит, преждевременный разрыв плодных оболочек и преждевременные роды, ГСД.
Полное понимание обширного материнского микробиома и его адаптации на протяжении беременности остается неполным. Для всестороннего изучения динамики микробиома во время беременности в различных группах населения и на разных стадиях беременности необходимо собрать более обширные данные, чтобы выявить универсальные показатели здоровья матери для всестороннего понимания их влияния на репродуктивное здоровье. Эти знания имеют потенциал для повышения точности диагностики, разработки целевых вмешательств и снижения риска перинатальных осложнений.
Подробное изучение микробиоты беременных и родильниц, процесса передачи микроорганизмов от матери к ребенку даст нам возможность выявления предикторов патологических процессов в периоде беременности, раннем и позднем послеродовом периодах, периоде новорожденности, а также послужит субстратом для выявления групп риска и создания алгоритмов обследования, предотвращения инфекционно-воспалительных осложнений у беременных, родильниц и новорожденных.
Список литературы
1. Wilmanski T, Diener C, Rappaport N, Patwardhan S, Wiedrick J, Lapidus J, et al. Gut microbiome pattern reflects healthy ageing and predicts survival in humans. Nat Metab. 2021; 3(2):274-286. DOI: https://doi.org/10.1038/s42255-021-00348-0
2. Xiao L, Zhao F. Microbial transmission, colonisation and succession: From pregnancy to infancy. Gut. 2023;72:772-86. DOI: https://doi.org/10.1136/gutjnl-2022-328970
3. Husain S, Allotey J, Drymoussi Z, Wilks M, Fernandez-Felix BM, Whiley A, Dodds J, Thangaratinam S, McCourt C, Prosdocimi EM, Wade WG, de Tejada BM, Zamora J, Khan K, Millar M. Effects of oral probiotic supplements on vaginal microbiota during pregnancy: a randomised, double-blind, placebo-controlled trial with microbiome analysis. BJOG. 2020;127(2):275-284. DOI: https://doi.org/10.1111/1471-0528.15675
4. Eckermann HA, Meijer J, Cooijmans K, Lahti L, de Weerth C. Daily skin-to-skin contact alters microbiota development in healthy full-term infants. Gut Microbes. 2024;16(1):2295403. DOI: https://doi.org/10.1080/19490976.2023.2295403
5. Карахалис Л. Ю., Иванцив Н. С. Влияние влагалищной микробиоты на течение беременности и роды. Кубанский научный медицинский вестник. 2020; 27(6):30-43.
6. Гаврилова Л. И., Билимова С. И., Чистякова Г. Н. Спектр микроорганизмов, выделенных из плаценты матери и организма новорожденного ребенка Научная дискуссия: вопросы медицины. - 2016;1(32):97-101.
7. Zhu B, Tao Z, Edupuganti L, Serrano MG, Buck GA. Roles of the Microbiota of the Female Reproductive Tract in Gynecological and Reproductive Health. Microbiol Mol Biol Rev. 2022;86(4):e0018121. DOI: https://doi.org/10.1128/mmbr.00181-21
8. Михельсон А. А., Телякова М. И., Лазукина М. В. Характеристика маточного микробиома у женщин с дефектом рубца на матке после кесарева сечения. Гинекология. 2023;25 (3):348-352.
9. Cocomazzi G, De Stefani S, Del Pup L, Palini S, Buccheri M, Primiterra M, Sciannamè N, Faioli R, Maglione A, Baldini GM, Baldini D, Pazienza V. The Impact of the Female Genital Microbiota on the Outcome of Assisted Reproduction Treatments. Microorganisms. 2023;11(6):1443. DOI: https://doi.org/10.3390/microorganisms11061443
10. Бусоргина, М. О., Оппедизано Д. Л. Влияние микробиоты влагалища на течение беременности. Forcipe. 2023;6 (2): 97. [Busorgina, M. O., Oppedizano D. L. The influence of vaginal microbiota on the course of pregnancy. Forcipe. 2023; 6(2):97 (In Russ).] https://www.elibrary.ru/item.asp?id=65586015
11. Браславская Е.П., Мелкозерова О.А., Михельсон А.А. Функциональные нарушения и особенности микробиоты кишечника при рецидивирующем течении глубокого эндометриоза. Вестник охраны материнства и младенчества. 2024;1(2):12-14.
12. Alemu BK, Wu L, Azeze GG, Lau SL, Wang Y, Wang CC. Microbiota-targeted interventions and clinical implications for maternal-offspring health: An umbrella review of systematic reviews and meta-analyses of randomised controlled trials. J Glob Health. 2024 Sep 13;14:04177. DOI: https://doi.org/10.7189/jogh.14.04177
13. Билимова, С.И., Чистякова Г.Н., Ремизова И.И. Комплексная оценка вагинальной микробиоты методом ПЦР в режиме реального времени Уральский медицинский журнал. 2010;5(70):135-138.
14. López-Moreno A, Aguilera M. Vaginal Probiotics for Reproductive Health and Related Dysbiosis: Systematic Review and Meta-Analysis. J Clin Med. 2021; 10(7):1461. DOI: https://doi.org/10.3390/jcm10071461
15. Moreno I., Garcia-Grau I., Perez-Villaroya D., Gonzalez Monfort M., Bahceci M., BarrionuevoM M.J., Taguchi S., Puente E., Dimattina E., Lim M.W., Meneghini G., Aubuchon M., Leondires M., Izquierdo A., Perez-Olgiati M., Chavez A., Seethram K., Bau D., Gomez C., Valbuena D., Vilella F., Simon C. Endometrial microbiota composition is associated with reproductive outcome in infertile patients Microbiome, 2022; 10(1), 10.1186/s40168-021-01184-w https://doi.org/10.1016/j.jri.2024.104251
16. Устюжанин А.В., Ремизова И.И., Чистякова Г.Н., Смирнова Т.Г. Результаты микробиологического исследования отделяемого влагалища у беременных женщин с миомой матки. XXXIX международные научные чтения (памяти А.Е. Коварского): сборник статей Международной научно-практической конференции, Москва, 02 декабря 2018 года. - Москва: ООО “Европейский фонд инновационного развития”, 2018:103-106.
17. Xiao L, Zhou T, Zuo Z, Sun N, Zhao F. Spatiotemporal patterns of the pregnancy microbiome and links to reproductive disorders. Sci Bull (Beijing). 2024; 69(9):1275-1285. DOI: https://doi.org/10.1016/j.scib.2024.02.001
18. Червинец Ю. В., Червинец В. М., Стольникова И. И., Досова С. Ю. Особенности микробиоты влагалища при привычном невынашивании беременности. Тверской медицинский журнал. 2021; 2:33-43.
19. Винникова, С. В., Цечоева Л. Ш. Особенности состояния влагалищной микробиоты у женщин с неразвивающейся беременностью. Global Reproduction. 2021;1: 51-56.
20. Dube R, Kar SS. Genital Microbiota and Outcome of Assisted Reproductive Treatment-A Systematic Review. Life (Basel). 2022;12(11):1867. DOI: https://doi.org/10.3390/life12111867
21. Shi et al., Xiao L, Zhou T, Zuo Z, Sun N, Zhao F. Spatiotemporal patterns of the pregnancy microbiome and links to reproductive disorders. Sci Bull (Beijing). 2024;69(9):1275-1285. DOI: https://doi.org/10.1016/j.scib.2024.02.001
22. Peuranpaa P., Holster T., Saqib S., Kalliala I., Tiitinen A., . Salonen A, Hautamaki H. Female reproductive tract microbiota and recurrent pregnancy loss: a nested casecontrol study Reprod. Biomed. Online, 2022; 45:1021- 1031, https://doi.org/10.1016/j.rbmo.2022.06.008
23. Petricevic L, Rosicky I, Kiss H, Janjic N, Kaufmann U, Holzer I, Farr A. Effect of vaginal probiotics containing Lactobacillus casei rhamnosus (Lcr regenerans) on vaginal dysbiotic microbiota and pregnancy outcome, prospective, randomized study. Sci Rep. 2023;13(1):7129. DOI: https://doi.org/10.1038/s41598-023-34275-9
24. Kunasegaran T, Balasubramaniam VRMT, Arasoo VJT, Palanisamy UD, Ramadas A. Diet Gut Microbiota Axis in Pregnancy: A Systematic Review of Recent Evidence. Curr Nutr Rep. 2023;12(1):203-214. DOI: https://doi.org/10.1007/s13668-023-00453-4
25. Gudnadottir U, Debelius JW, Du J, Hugerth LW, Danielsson H, Schuppe-Koistinen I, Fransson E, Brusselaers N. The vaginal microbiome and the risk of preterm birth: a systematic review and network meta-analysis. Sci Rep. 2022;12(1):7926. DOI: https://doi.org/10.1038/s41598-022-12007-9
26. Каганова М.А. Спиридонова Н.В. Девятова О.О. Влияние микробиоты мочевыводящих путей но преждевременный разрыв плодных оболочек при доношенной беременности Практическая медицина. 2020; 8 (2):35-41.
27. Устюжанин А.В., Чистякова Г.Н., Маханек А.А., Ремизова И.И. Результаты микробиологического исследования проб мочи беременных женщин, госпитализированных в 2022 г Материалы XII Съезда Всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов, Москва, 26–28 октября 2022 года / Под редакцией А.Ю. Поповой, В.Г. Акимкина. — Москва: Федеральное бюджетное учреждение науки “Центральный научно-исследовательский институт эпидемиологии” Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, 2022: 274-275.
28. Mokkala K, Paulin N, Houttu N, Koivuniemi E, Pellonperä O, Khan S, Pietilä S, Tertti K, Elo LL, Laitinen K. Metagenomics analysis of gut microbiota in response to diet intervention and gestational diabetes in overweight and obese women: a randomised, double-blind, placebo-controlled clinical trial. Gut. 2021;70(2):309-318. DOI: https://doi.org/10.1136/gutjnl-2020-321643
29. Siena M, Laterza L, Matteo MV, Mignini I, Schepis T, Rizzatti G, Ianiro G, Rinninella E, Cintoni M, Gasbarrini A. Gut and Reproductive Tract Microbiota Adaptation during Pregnancy: New Insights for PregnancyRelated Complications and Therapy. Microorganisms. 2021;9(3):473. DOI: https://doi.org/10.3390/microorganisms9030473
30. Feng T, Liu Y. Microorganisms in the reproductive system and probiotic’s regulatory effects on reproductive health. Comput Struct Biotechnol J. 2022; 20:1541-1553. DOI: https://doi.org/10.1016/j.csbj.2022.03.017
31. Giannella L, Grelloni C, Quintili D, Fiorelli A, Montironi R, Alia S, Delli Carpini G, Di Giuseppe J, Vignini A, Ciavattini A. Microbiome Changes in Pregnancy Disorders. Antioxidants (Basel). 2023 Feb 12;12(2):463. DOI: https://doi.org/10.3390/antiox12020463
32. Huang C, Gin C, Fettweis J, Foxman B, Gelaye B, MacIntyre DA, Subramaniam A, Fraser W, Tabatabaei N, Callahan B. Meta-analysis reveals the vaginal microbiome is a better predictor of earlier than later preterm birth. BMC Biol. 2023;21(1):199. DOI: https://doi.org/10.1186/s12915-023-01702-2
33. Yao Y, Cai X, Chen C, Fang H, Zhao Y, Fei W, Chen F, Zheng C. The Role of Microbiomes in Pregnant Women and Offspring: Research Progress of Recent Years. Front Pharmacol. 2020; 11:643. DOI: https://doi.org/10.3389/fphar.2020.00643
34. Amir M, Brown JA, Rager SL, Sanidad KZ, Ananthanarayanan A, Zeng MY. Maternal Microbiome and Infections in Pregnancy. Microorganisms. 2020;8(12):1996. DOI: https://doi.org/10.3390/microorganisms8121996
35. Ding Q, Hu Y, Fu Y, Qian L. Systematic review and meta-analysis of the correlation between intestinal flora and gestational diabetes mellitus. Ann Palliat Med. 2021;10(9):9752-9764. DOI: https://doi.org/10.21037/apm-21-2061
36. Li X, Zhang L, He Y, Zhang D, Zhang S. Probiotics for the prevention of gestational diabetes mellitus: A meta-analysis of randomized controlled trials. Biomol Biomed. 2024;24(5):1092-1104. DOI: https://doi.org/10.17305/bb.2024.10377
37. Шмакова Н. А., Чистякова Г. Н., Кононова И. Н., Ремизова И. И. Особенности цервико-вагинального микробиоценоза с определением видового состава лактобактерий у пациенток с цервикальными интраэпительными неоплазиями. Лечение и профилактика. 2020. Т. 10, № 3. С. 30-35.
38. Stupak A, Kwaśniewski W. Evaluating Current Molecular Techniques and Evidence in Assessing Microbiome in Placenta-Related Health and Disorders in Pregnancy. Biomolecules. 2023;13(6):911. DOI: https://doi.org/10.3390/biom13060911
39. Zhao F, Hu X, Ying C. Advances in Research on the Relationship between Vaginal Microbiota and Adverse Pregnancy Outcomes and Gynecological Diseases. Microorganisms. 2023;11(4):991. DOI: https://doi.org/10.3390/microorganisms11040991
40. Yang M, Wang M, Li N. Advances in pathogenesis of preeclampsia. Arch Gynecol Obstet. 2024;309(5):1815- 1823 https://doi.org/10.1007/s00404-024-07393-6
41. Patro JN, Ramachandran P, Lewis JL, Mammel MK, Barnaba T, Pfeiler EA, et al. Development and utility of the FDA ‘GutProbe’DNA microarray for identification, genotyping and metagenomic analysis of commercially available probiotics. J Appl Microbiol. 2015;118:1478– 88. 10.1111/jam.12795. DOI: https://doi.org/10.1111/jam.12795
42. Alexander C, Rietschel ET. Bacterial lipopolysaccharides and innate immunity. J Endotoxin Res. 2001;7:167-202. DOI: https://pubmed.ncbi.nlm.nih.gov/11581570/
43. Pérez-Castillo Í.M., Fernández-Castillo R., Lasserrot-Cuadrado A., Gallo-Vallejo J.L., Rojas-Carvajal A.M., Aguilar-Cordero M.J. Reporting of perinatal outcomes in probiotic randomized controlled trials. A systematic review and meta-analysis. Nutrients. 2021;13:256. 10.3390/nu13010256. DOI: https://doi.org/10.3390/nu13010256.
Об авторах
И. В. ДаньковаРоссия
Данькова Ирина Владимировна — кандидат медицинских наук, старший научный сотрудник отделения сохранения репродуктивной функции женщин, врач акушер-гинеколог
ул. Репина, д. 1, г. Екатеринбург, 620028
Тел.: (343) 371-08-78, +79122877465
Е. Г. Дерябина
Россия
Дерябина Елена Геннадьевна — доктор медицинских наук, ведущий научный сотрудник отделения антенатальной охраны плода, врач-эндокринолог
ул. Репина, д. 1, г. Екатеринбург, 620028
М. А. Маликова
Россия
Маликова Мария Александровна — врач-ординатор акушер-гинеколог
ул. Репина, д. 1, г. Екатеринбург, 620028
Рецензия
Для цитирования:
Данькова И.В., Дерябина Е.Г., Маликова М.А. Микробиом беременности (обзор литературы). Вестник охраны материнства и младенчества. 2024;1(3):25-41. https://doi.org/10.69964/BMCC-2024-1-3-25-41
For citation:
Dankova I.V., Deryabina E.G., Malikova M.A. Microbiome of pregnancy (literature review). Bulletin of maternal and child care. 2024;1(3):25-41. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-3-25-41









