Перейти к:
Синдром обратной артериальной перфузии: дискуссионные вопросы тактики ведения (обзор литературы и клиническое наблюдение)
https://doi.org/10.69964/BMCC-2025-2-3-24-37
Аннотация
Цель. Провести обзор современной литературы и осветить современный подход к диагностике и лечению синдрома обратной артериальной перфузии (СОАП).
Материалы и методы. Для исследования использован обзор литературы из баз данных Medline, Scopus, Web of Science, Google Scholar, PubMed, Wiley и Cochrane Library. Проанализирован клинический случай обратной артериальной перфузии.
Результаты. Был рассмотрен патогенез синдрома обратной артериальной перфузии, освещены причины и ошибки в постановке диагноза СОАП. Сформированы основные ультразвуковые критерии для динамического наблюдения и оценки прогнозов для здорового плода. Освещены возможные тактики ведения данных пациентов в зависимости от клинической ситуации, а также возможные методы коррекции при прогрессировании СОАП.
Заключение. Анализ данных литературы показал, что существуют различные подходы к наблюдению и лечению СОАП, на данный момент есть однозначное мнение что, необходима ранняя диагностика, комплексное наблюдение, и своевременное оперативное лечение при прогрессировании СОАП. Дальнейшее изучение ультразвуковых признаков прогрессирования синдрома обратной артериальной перфузии и разработка четких алгоритмов наблюдения и оперативного лечения позволит улучшить перинатальные исходы для здорового плода (плод-помпа).
Ключевые слова
Для цитирования:
Панов А.Е., Коцуба Д.Р., Ярыгина Т.А. Синдром обратной артериальной перфузии: дискуссионные вопросы тактики ведения (обзор литературы и клиническое наблюдение). Вестник охраны материнства и младенчества. 2025;2(3):24-37. https://doi.org/10.69964/BMCC-2025-2-3-24-37
For citation:
Panov A.E., Kotsuba D.R., Yarygina T.A. Twin reversed arterial perfusion syndrome: controversial issues of management tactics (literature review and clinical observation). Bulletin of maternal and child care. 2025;2(3):24-37. (In Russ.) https://doi.org/10.69964/BMCC-2025-2-3-24-37
Многоплодная беременность сопряжена с высокой частой перинатальных осложнений и неблагоприятных исходов [1], ассоциированных с патологическими состояниями, как встречающимися при беременности одним плодом, так и с уникальными осложнениями монохориального многоплодия [2], в число которых входит синдром обратной артериальной перфузии (СОАП). Частота данной патологии, составляет 2,6% от всех случаев многоплодной монохориальной беременности [3][4]. Это осложнение характеризуется отсутствием функционирующего сердца одного из плодов (акадиуса), приводящим к формированию грубых аномалий его развития [5]. Поддержание развития и роста плода акардиуса происходит по артерио-артериальному анастомозу, кровь поступает от нормального плода (плода-помпы), к плоду с акардией, а по вено-венозному она возвращается. Недоразвитие большинства систем органов у плода с акардией возникает из-за гемодинамических нарушений, связанных с тем, что кровь от плода-помпы поступает с низкой концентрацией кислорода и под небольшим давлением [6].
Логично задаться вопросом в чем же заключается сложность обнаружения и диагностики для специалистов антенатальной охраны плода? С одной стороны, может показаться что это довольно легко, но на деле нередко врачи классифицируют данное состояние как антенатальная гибель и/или грубые аномалии развития одного из плодов, что приводит к неблагоприятным исходам беременности, осложненные синдромом обратной артериальной перфузии (СОАП).
Своевременная и точная диагностика данного синдрома возможна при знании эхографических признаков и специфических особенностей течения беременности.
К основным ультразвуковым критериям СОАП относятся [7-9]: отсутствие или рудиментарное сердце и реверсный кровоток в артерии пуповины у аномально сформированного плода по данным допплерографии. Обратный кровоток в артерии пуповины является результатом отсутствия функционирующего сердца и наличием артерио-артериальных анастомозов в плаценте. К дополнительным эхографическим признакам относятся выраженные аномалии развития одного из плодов: отсутствие или недоразвитие головы, конечностей, внутренних органов, утолщение воротникового пространства, генерализованный отек, единственная артерия пуповины, выраженное несоответствие фетометрических параметров плодов, многоводие у плода-помпы. Как правило, плод-помпа анатомически сформирован нормально и не имеет каких-либо пороков развития, однако, при прогрессировании СОАП, значительное увеличение объема циркулирующей крови и перегрузка системы кровообращения приводят к кардиомегалии и водянке.
В случае если данная патология была обнаружена своевременно, возникает вопрос — Что делать дальше? Синдром обратной артериальной перфузии представляет собой сложную клиническую проблему, характеризующуюся неоднозначностью подходов к ведению таких беременностей. Определение критериев риска неблагоприятного исхода играет ключевую роль в принятии клинических решений. Выбор оптимальной тактики лечения — консервативной или оперативной, остается предметом активных дискуссий в медицинском сообществе. При хирургическом вмешательстве актуальным является вопрос выбора наиболее эффективной методики и оптимального срока проведения внутриутробной коррекции. Таким образом, поиск путей решения указанных проблем является важной задачей современной перинатологии.
Очевидно, что главной целью ведения беременности, осложненной СОАП, является рождение одного здорового ребенка. Кроме подтверждения диагноза, диагностика должна быть направлена на оценку риска развития сердечной недостаточности и риска антенатальной гибели плода-помпы. Для оценки внутриутробного состояния плода-помпы необходимо оценивать: кардио-торакальное соотношение, толщину стенок желудочков, оценка кровотока в венозном протоке, измерение количества амниотической жидкости (нарастание степени многоводия) плода-помпы, соотношение диаметра пупочной вены (UVD) и диаметра акардиальной вены, увеличение пиковой скорости средней мозговой артерии, отношение индекса пульсации пупочной артерии у акардиального/насосного близнеца менее 1. Внимание специалистов не должно быть сконцентрировано исключительно на здоровом плоде и оценке его состояния так как, плод с акардией так же кровоснабжается за счет плода-помпы. При прогрессировании синдрома обратной артериальной перфузии плод с акардией так же растет, что необходимо так же учитывать при оценке степени тяжести СОАП. Согласно клиническим рекомендациям признаками прогрессирования СОАП являются сохранение кровотока в сосудах плода с акардией, увеличение его массы, нарастание его размеров, превышающих 50% размеров плода-помпы, из чего следует декомпенсация плода-помпы — формирования УЗ признаков кардиомиопатии и многоводия. Возникает вопрос, если один из критериев оценки прогрессирования СОАП является оценка массы плода с акардией, то как ее рассчитывать, если стандартные методы ультразвуковой биометрии не могут быть использованы ввиду отсутствия необходимых анатомических структур?
Обычно используют данное уравнение: Масса (граммы) = длина × ширина × высота × 0,52 в сантиметрах, или с помощью 3D-ультразвука, где 1 мл будет равен 1 грамму. Зарубежными авторами T. R. Moore, S. Gale и K. Benirschke для оценки массы плода с акардией была предложена следующая формула: вес (г) = 1,2 × (наибольшая длина в см)² — (1,7 × наибольшая длина в см), где L — максимальная длина близнеца с акардией. Moore и соавт., основываясь на анализе 49 случаев беременностей, осложненных СОАП, предложили методику оценки риска неблагоприятного исхода, где ключевым параметром является соотношение массы акардиального плода к массе плода-помпы. Было установлено, что соотношение более 70% ассоциировано с повышенным риском преждевременных родов, многоводия и сердечной недостаточности у плода-помпы. [10].
Учитывая сложность определения массы акардиального плода, Wong et al. предложили использовать окружность живота (ОЖ) в качестве основного прогностического параметра. Разработанная классификация, основанная на размере ОЖ акардиуса и признаках нарушения сердечной функции у плода-помпы, позволяет выявлять наиболее тяжелые случаи, требующие хирургической коррекции.
По данной классификации акардиальные плоды подразделяются на:
Тип I: малые или средние акардиальные плоды, соотношение окружности живота <50%.
Тип II: крупные акардиальные плоды, у которых соотношение окружности живота составляет ≥50%.
Каждый тип может быть дополнительно разделен на «подтип a», если у близнеца-помпы отсутствуют признаки сердечно-сосудистой недостаточности, или на «подтип b», если эти маркеры недостаточности присутствуют.[11]
Классификация Wang et al. позволяет прогнозировать исход беременности при наличии акардиального плода. Тип Ia предполагает консервативное ведение с УЗ-мониторингом (благоприятный исход в 88%). При типе Ib требуется повторное УЗИ для оценки динамики и решения о необходимости инвазивного лечения. Тип IIa, даже без сердечной недостаточности у плода-помпы, может потребовать пренатального лечения из-за риска преждевременных родов, обусловленного большими размерами акардиуса. Тип IIb требует немедленного вмешательства.
Из всего вышеописанного выстраивается алгоритм ведения данной группы пациентов:
- После установления диагноза СОАП, включает оценку состояния плода-помпы — проводится полное и подробное исследование анатомии с целью выявления аномалий развития, так как известно, что при монохориальной беременности их частота выше.
- Оценка функции сердца плода-помпы – измеряется сердечно-грудное соотношение, толщина стенки желудочка, кровоток в венозном протоке.
- Наблюдение за плодом с акардией — его размеры, степень кровоснабжения, так как известно, что его большие размеры и быстрый рост связаны с риском гибели плода-помпы. Кроме того, оценивают количество амниотической жидкости. Возникающее многоводие при прогрессировании СОАП может привести к преждевременным родам.
Благодаря современным ультразвуковым методам диагностика СОАП возможна уже в первом триместре беременности. В связи с этим возможно раннее динамическое наблюдение за данной беременностью и при отсутствии признаков прогрессирования СОАП динамическое наблюдение проводится до доношенного срока беременности и родоразрешение в плановом порядке, роды оформляются как одноплодные роды, а плод с акардией расценивается как продукты зачатия.
Но в случае прогрессирования СОАП, перед врачами возникает вопрос о выборе оптимальной стратегии:
- выжидательная тактика:мониторинг состояния плода-помпы с возможным вмешательством при появлении признаков декомпенсации.
- превентивное вмешательство:проведение процедуры с целью сохранения плода-помпы вне зависимости от ультразвуковой картины.
Оптимальные сроки хирургической коррекции синдрома обратной артериальной перфузии (СОАП) остаются предметом активных дискуссий в клинической практике. Традиционно считалось, что вмешательство следует проводить на 16–18 неделе гестации, исходя из предположения о снижении риска прерывания беременности после слияния амниотической и хориальной полостей. Однако важно учитывать, что к этому сроку частота спонтанной потери беременности при СОАП может быть достаточно высокой. [12][13]
Ретроспективное исследование Lewi и соавт. (2010) выявило высокую частоту потери плода-помпы (33%) в период между диагностикой в первом триместре и плановым вмешательством на 16-18 неделях. Сходные данные были получены Pagani и соавт., которые отметили высокую частоту спонтанных потерь (83%) при консервативном ведении. Объединенный анализ данных Pagani и соавт. с результатами других исследований показал значительное снижение риска неблагоприятных исходов при вмешательстве до 16 недели гестации. [14][15].
Tavares de Sousa и соавт. сообщили о частоте живорождений 92% при медиане гестационного возраста 39 недель и 6 дней в группе из 12 случаев коррекции СОАП, проведенной до 14 недель беременности. [16]
Контраверсионным выглядит ретроспективный анализ Roethlisberger и соавт. (2017) который показал, что при коррекции СОАП до 14 недель беременности частота неблагоприятных исходов составила 42%. [17].
Таким образом, из-за невозможности прогнозирования осложнений СОАП, случаев гибели плода-помпы без признаков его декомпенсации, большинство исследователей выступают за профилактическое внутриутробное лечение до 16 недель гестации
Разрешить вопрос об оптимальных сроках коррекции СОАП призвано многоцентровое открытое рандомизированное контролируемое исследование TRAPIST (TRAP Intervention Study, ClinicalTrials.gov: NCT02621645), в котором сравнивается эффективность вмешательств, проводимых на 13–15 неделях гестации, с коррекцией, выполняемой с 16 недель.
Методы лечения
Изначально лечение синдрома СОАП ограничивалось симптоматической терапией. Применяли дигоксин для уменьшения явлений сердечной недостаточности у плода-помпы, а индометацин и серии амниоцентезов применялись для уменьшения многоводия и снижения частоты преждевременных родов. [18-20]
В 1989 году Robie et al. впервые выполнил хирургическую коррекцию СОАП — гистеротомию на гестационном сроке 22 недели, удалив акардиального плода и создав условия для дальнейшего вынашивания плода-помпы. Несмотря на сообщения о других подобных случаях, эта методика не получила широкого распространения из-за высокой частоты серьёзных осложнений. [21]
С наступлением 90-х годов началась эра малоинвазивной хирургии, ознаменованная развитием пункционных и фетоскопических методик. Среди них можно выделить методы окклюзии сосудов пуповины акардиального плода и техники интрафетальной абляции, а также их различные комбинации.
Окклюзия пуповины
В 1989 году Hamada и соавторы впервые выполнили чрескожную окклюзию пуповины акардиального плода, путем введения эмболизирующего вещества.[22]
Впоследствии были предложены и другие методы остановки кровообращения в сосудах пуповины, включая лигирование под контролем УЗИ и фетоскопии [23], открытым гистеротомическим способом [24], а также окклюзию сосудов с использованием различных тромбирующих агентов. [25]
Выполнялась как монополярная [26][27], так и биполярная [28][29] коагуляция. Традиционно биполярная коагуляция считается более безопасной из-за ограниченной зоны воздействия, однако применение инструментов большего диаметра при ее проведении может повышать риск преждевременного разрыва плодных оболочек.
В 1994 году Ville и соавт. сообщили о лазерной коагуляции сосудов пуповины во время фетоскопии с помощью неодимового лазера.[30]
В 1998 году Arias и соавт. опубликовали систематический обзор, включающий 22 случая различных инвазивных способов коррекции СОАП. Был сделан вывод, что лазерная фетоскопическая окклюзия сосудов пуповины с помощью неодимового лазера оказалась лучшим методом коррекции, если она проводилась после 24 недели гестации. [31]
Фетоскопическое лигирование сосудов пуповины и лазерная коагуляция сопряжены с недостатками, включая 10% технических неудач, повышенный риск ПРПО, внутриамниотической инфекции и кровотечения у плода-помпы. Эндоскопическое лигирование требует общей анестезии и введения минимум двух 12-калибровых троакаров. Расположение плаценты по передней стенке так же является относительным ограничением метода. Фетоскопия также требует дорогостоящего оборудования, обученных специалистов и доступна не во всех центрах [31][32].
Независимо от выбранного метода воздействия на пуповину акардиального плода, существует значительный риск повреждения пуповины плода-помпы, особенно при их близком расположении[42]. Кроме того, отёчность пуповины, часто наблюдаемая у акардиальных плодов, может затруднить проведение лазерной или биполярной коагуляции.
Интрафетальная абляция
Интрафетальная абляция — комплекс методик направленных на блокирование кровотока в тазовых сосудах и/или брюшной аорте акардиального плода. Сосуды-мишени легко идентифицируются при цветовом допплеровском картировании. Важно отметить, что эффективность процедуры не зависит от расположения плаценты, структуры пуповины, количества амниотической жидкости и положения акардиуса.
В 1995 году Sepulveda сообщил о первом успешном случае абляции с использованием 99% спирта [33]. С тех пор методы интрафетальной абляции значительно эволюционировали и включают монополярную диатермокоагуляцию, лазерную и радиочастотную абляцию, выполняемые под ультразвуковым контролем.
Монополярная диатермокоагуляция:
Процедура проводится на ранних сроках беременности, амбулаторно, под местной анестезией, с помощью иглы 18G. Устройство включает в себя: изолированным PTFE электрод диаметром 1 мм, заземляющую пластину и стандартный генератор. Основной риск — термическое повреждение плода-помпы или тканей матери, расположенных вблизи электрода. [26]
Лазерная интрафетальная коагуляция
Процедура выполняется под местной анестезией с использованием иглы 18 калибра, лазерного волокна и генератора [34][35]. Технические навыки аналогичны другим инвазивным вмешательствам, требующим пункции иглой: под ультразвуковым контролем иглу вводят в брюшную полость или таз акардиального плода вблизи целевых сосудов. Затем через иглу проводят лазерное волокно, контролируя, чтобы его кончик выступал за пределы иглы на небольшое расстояние. Лазерные импульсы применяют, при необходимости увеличивая мощность, до тех пор, пока окклюзия кровеносных сосудов не приведет к прекращению допплеровского сигнала при цветовом допплеровском картировании.
Интерстициальный лазер, в отличие от монополярной диатермии, не несет риска ожогов. Как и другие интрафетальные методы, он минимизирует риск повреждения плода-помпы, так как воздействие происходит внутри тела акардиуса. Использование пункционной иглы малого диаметра, снижает риск разрыва плодных оболочек. Кроме того, в отличии от эндоскоптческих методик, интерстициальный лазер может применяться на ранних сроках гестации. [34].
Радиочастотная абляция (РЧА) — метод базируется на физическом принципе термокоагуляции и основан на эффекте выделения тепловой энергии при прохождении тока ультравысокой частоты через обладающую импедансом биологическую ткань. Устройство включает в себя радиочастотный генератор и специальное устройство с иглой диаметром 3 мм, на конце которой имеются зубцы, раскрывающиеся в форме «зонтика» [36]. Игла для РЧА вводится под ультразвуковым контролем в брюшной полости акардиального плода, зубцы устройства РЧА разворачиваются, подается энергия и происходит коагуляция тканей. Когда устройство обнаруживает увеличение импеданса ткани в результате некроза, воздействие энергии прекращается. Эффективность процедуры можно подтвердить с помощью допплеровского ультразвукового исследования [37]. Возможность повреждения близнеца-помпы или окружающих тканей исключена, поскольку энергия высвобождается из радиочастотного устройства только после развертывания в ткани акардиуса. Хотя устройство для РЧА имеет самый большой диаметр из всех трех методов, оно представляется относительно безопасным и эффективным в лечении СОАП.
Сравнение методик лечения
В последние годы от эндоскопических процедур почти отказались из-за значимого количества преждевременных родов, в то время как РЧА и интрафетальный лазер являются наиболее часто используемыми техниками, которые кажутся надежными и безопасными при лечении СОАП.
Как отмечалось ранее, методы окклюзии пуповины акардиального плода имеют ряд недостатков по сравнению с интрафетальными техниками. В своем обзоре литературы Tan и Sepulveda сравнили результаты коррекции СОАП с применением методов окклюзии пуповины (n-40) c использованием методов интрафетальной абляции (n-31). Анализ показал, что интрафетальная абляция демонстрирует более низкий уровень технических неудач (13% против 35%), меньшую частоту преждевременных родов и преждевременного разрыва плодных оболочек до 32 недель (23% против 58%) и лучшие клинические исходы (77% против 50%) [25].
Cabassa и др. опубликовали серию случаев и провели обзор существующей литературы по коррекции СОАП методом РЧА: было включено 6 исследований, в общей сложности 88 многоплодных беременностей (монохориальные двойни или тройни с монохориальным компонентом). Общая выживаемость новорожденных при использовании данной методики составила 85% . [37].
Lee и др. опубликовали анализ 98 случаев СОАП, леченных с помощью РЧА, с выживаемостью плода-помпы в 80% случаев [38]. Chaveeva и коллеги провели метаанализ, показавший общую выживаемость плода помпы после лечения РЧА 80,8% [39]. В исследовании Zhang и др. перечислены 11 случаев использования РЧА при СОАП. Общая выживаемость плода-помпы составила 70% [40].
Интрафетальное использование лазера при СОАП было предметом нескольких исследований. Pagani и др. в 2013 году провели ретроспективное когортное исследование и обзор литературы СОАП, с коррекцией интрафетальной лазерной хирургией. Всего был включен 51 случай. Общая выживаемость новорожденных составила 80%; неблагоприятный исход беременности (внутриутробная гибель плода помпы или преждевременные роды до 37 недель) был значительно ниже, когда лечение проводилось до 16 недели, в сравнении с беременностями, когда манипуляция проводилась на 16 неделе или позже (19%, против 66%) [15]. Chaveeva и др. в 2014 году добавили свою серию случаев и обновили метаанализ. Объединенные данные включали 104 беременности двойней, леченные с помощью интрафетального лазера. Общая выживаемость составила 76% [39].
Pagani и соавторы, анализируя серию случаев, отметили, что при сопоставимом уровне выживаемости новорожденных при использовании интрафетальных техник РЧА и лазерной коагуляции (85% против 82%), частота преждевременного разрыва плодных оболочек до 32 недель беременности была значительно выше при применении РЧА (22% против 7%) [15]. В многоцентровом исследовании, опубликованном Scheier и соавторами, у плода-помпы наблюдался более высокий уровень внутриутробной гибели при проведении РЧА на 15-19 неделях, по сравнению с РЧА, выполненной после 19 недель (33,3% против 10,7%) [41]. Chaveeva продемонстрировала, что риск смерти плода-помпы при использовании интрафетального лазера ниже, если вмешательство проводится на 12-14 неделях, чем на более поздних сроках беременности. В любом случае, объективное сравнение между интрафетальной РЧА и лазеркоагуляцией затруднительно из-за отсутствия данных о процедурах РЧА, выполненных до 15 недель беременности [39].
Клиническое наблюдение и проведенное лечение
Пациентка Б. 23 лет обратилась для проведения экспертного ультразвукового исследования в связи с необходимостью верификации диагноза. Общий, соматический, акушерско-гинекологический и семейным анамнез пациентки не были не отягощены. Данная беременность первая, наступила в результате естественного зачатия.
При плановом ультразвуковом исследовании, проведенном в рамках раннего пренатального скрининга по месту амбулаторного наблюдения пациентки, была диагностирована монохориальная диамниотическая двойня с признаками водянки и брадикардии у одного из плодов.
При проведении исследования в ГБУЗ МО «МОНИИАГ им. акад. В.И.Краснопольского», эхографическая картина соответствовала монохориальной диамниотической двойне, осложненной синдромом обратной артериальной перфузии
В верхней амниотической полости определялся плод с акардией, имеющий размеры 42*25*27 мм (объём 14 см3), копчико-теменным размером (КТР) 42 мм, и представленный аномальным позвоночником, фрагментами черепа и тазовых костей, рудиментарными верхними и нижними конечностями аномального строения, окружающие костные структуры мягкие ткани имели выраженный отек. В мягких тканях акардиального плода определялись множественные сосуды (рисунки 1а, 1б).
В нижней амниотической полости определялся живой плод-помпа, с КТР 61 мм, соответствующим гестационному сроку 12 недель 4 дня. Бипариетальный диаметр составлял 19 мм, окружности головы и живота — 72 мм и 61 мм, соответственно, длина бедренных костей — 6,2 мм. Предполагаемая масса плода — 58 грамм.
Сердцебиение плода-помпы было ритмичное, с частотой 144 удара в минуту. Сердце было увеличено с преобладанием правых отделов, определялся невыраженный гидроперикард по правым отделам (рисунок 2).
Определялась регургитация на трикуспидальном клапане со степенью 2+, тотальная регургитация на легочном клапане 4+, аномальный двунаправленный кровоток по легочной артерии (рисунки 3а,3б), аорте, артериям пуповины (рисунок 4), отрицательная а-волна в венозном протоке .ТВП 2,5 мм. Увеличение шейных яремных сосудов .Отека мягких тканей, асцита, гидроторакса не выявлено.
Максимальный вертикальный карман амниотической жидкости составлял 2,5 см в полости акардиального плода, 3,3 см — у плода-помпы. Плацента располагалась по передней стенке, структура и толщина соответствовали сроку гестации. Пуповина акардиального плода имела два сосуда с прикреплением к плаценте у межплодной мембраны на расстоянии 2,6 мм от пуповины плода-помпы, состоящей из трех сосудов (рисунок 5).
С учетом наличия эхографических и допплерографических признаков декомпенсации состояния плода-помпы, было принято решением о проведении лазерной аблации сосудов акардиального плода. У пациентки, проинформированной о высоком риске неблагоприятного исхода беременности, получено согласие на проведение данного метода лечения.
В связи с близким прикреплением пуповин от попытки коагулировать пуповину акардиального плода было решено воздержаться.
В асептических условиях под внутривенной анестезией и контролем УЗИ выполнен прокол передней брюшной стенки и стенки матки, иглой 18G, игла подведена к интраабдоминальному отделу пуповины акардиального плода. Лазером мощностью 40 Вт выполнена коагуляция сосудов. При контроле ЦДК в структурах акардиального плода кровотока не определяется (рисунок 6).
Сердцебиение плода помпы оставалось ритмичным с частотой сердечных сокращений 165 ударов в минуту. Осложнений после манипуляции не возникло.
Однако, несмотря на прекращение кровообращения акардиального плода, у плода-помпы сохранялись допплерографические признаки декомпенсации (рисунок 7а, 7б, 7в) и в сроке 15 недель произошла гибель.
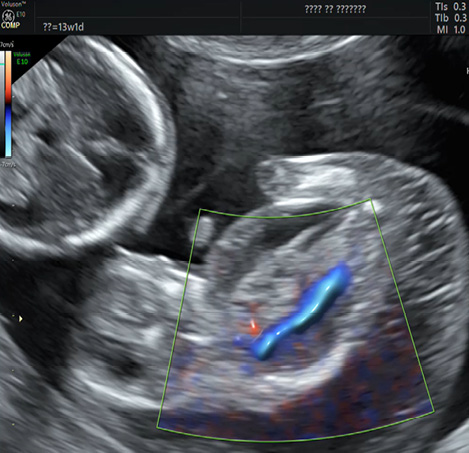
Рисунок 1а. Ультразвуковое изображение эхографическое изображение с использованием двунаправленного энергетического допплера: кровоток в сосуде акардиального плода.
Figure 1a. Ultrasound image is an echographic image using a bidirectional energy doppler: blood flow in the vessel of the acardial fetus.
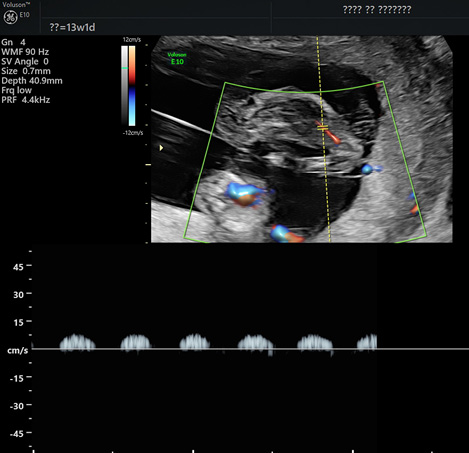
Рисунок 1б. Ультразвуковое изображение эхографическое изображение в режиме триплексного картирования: кривая скорости кровотока в сосуде акардиального плода
Figure 1b. Ultrasound image echographic image in triplex mapping mode: blood flow velocity curve in the vessel of the acardial fetus
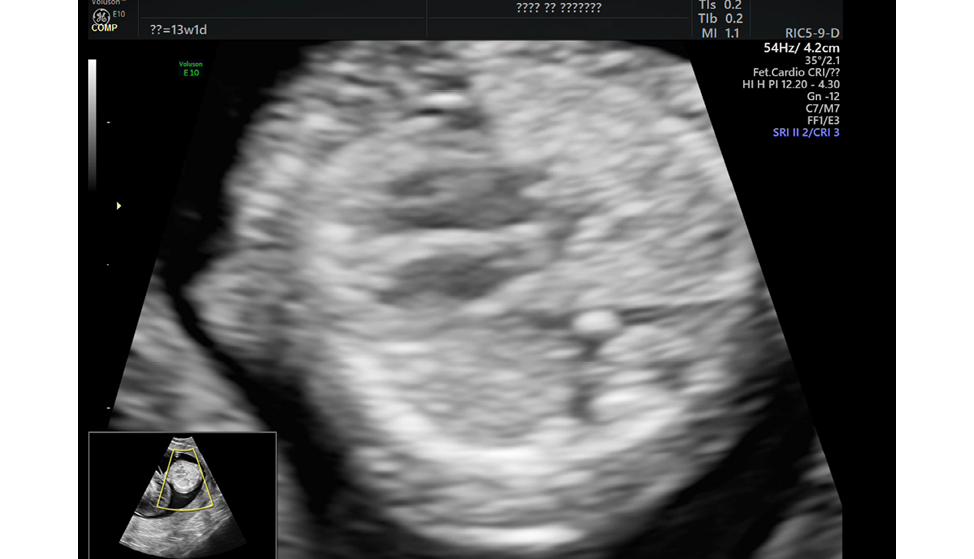
Рисунок 2. Ультразвуковое изображение эхографическое изображение сердца плода-помпы в режиме 2Д (комментарии в тексте).
Figure 2. Ultrasound image echographic image of the fetal heart pump in 2D mode
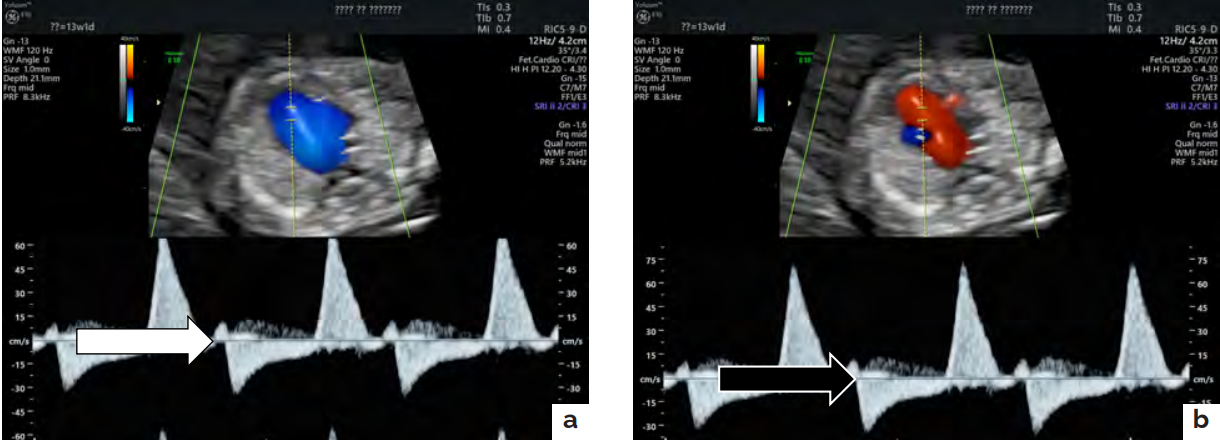
Рисунок 3. Ультразвуковое изображение эхографическое изображение среза через 3 сосуда и трахею плода — помпы в режиме триплексного картирования: кривая скорости кровотока в легочной артерии. а — антеградный кровоток в систолу (синий цвет потока, указан белой стрелкой); b — ретроградный кровоток в диастолу (красный цвет потока, указан черной стрелкой стрелкой)
Figure 3. Ultrasound image an echographic image of a section through 3 vessels and the fetal trachea of a pump in the triplex mapping mode: a curve of blood flow velocity in the pulmonary artery. а — antegrade blood flow to the systole (blue flow color, indicated by a white arrow); b — retrograde blood flow in the diastole (red flow color, indicated by a black arrow arrow).
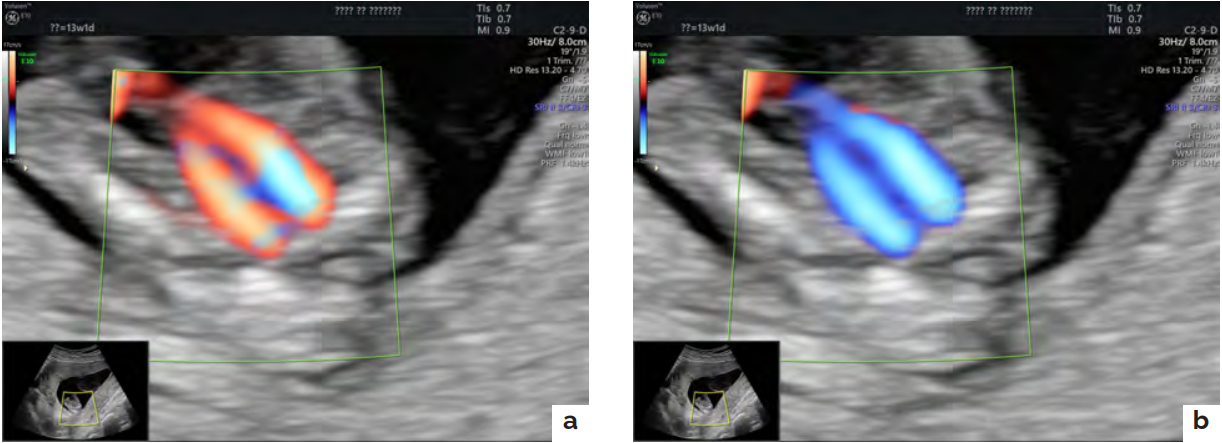
Рисунок 4. Ультразвуковое изображение эхографическое изображение паравезикального среза через артерии пуповины плода — помпы с использованием двунаправленного энергетического допплера: а — антеградный кровоток в систолу (красный цвет потока); b — ретроградный кровоток в диастолу (синий цвет потока)
Figure 4. Ultrasound image an echographic image of a paravesical section through the arteries of the fetal umbilical cord using a bidirectional energy doppler: а — antegrade blood flow to the systole (red flow color); b — retrograde blood flow in the diastole (blue flow color)
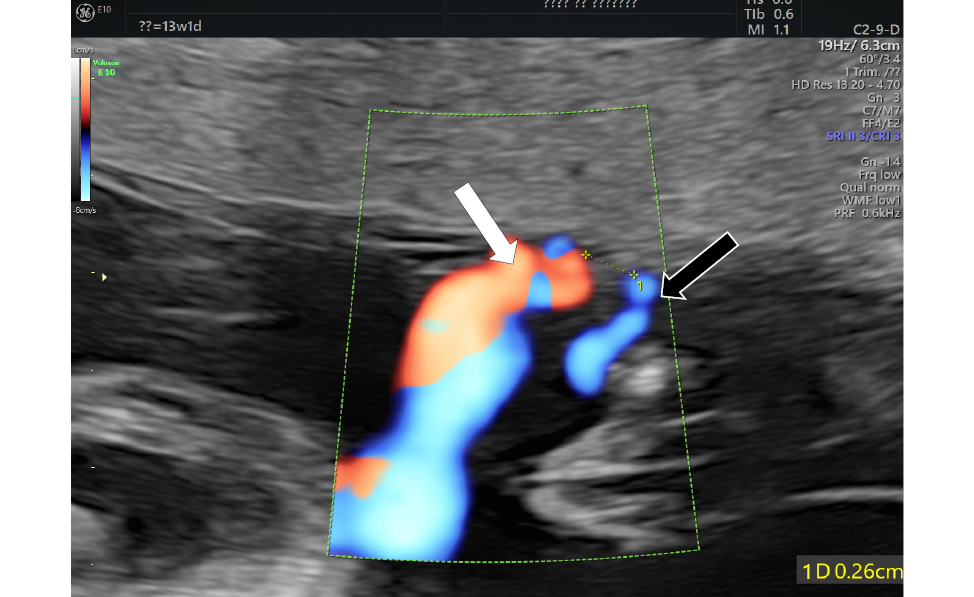
Рисунок 5. Ультразвуковое изображение эхографическое изображение с использованием двунаправленного энергетического допплера: расстояние между местами прикрепления к плаценте пуповины плода-помпы (указано белой стрелкой) и акардиального плода (указано черной стрелкой) указано каллиперами.
Figure 5. Ultrasound image an echographic image using a bidirectional energy doppler: the distance between the attachment points to the placenta of the umbilical cord of the fetus-the pump (indicated by the white arrow) and the acardial fetus (indicated by the black arrow) is indicated by callipers.
Рисунок 6. Ультразвуковое изображение эхографическое изображение с использованием двунаправленного энергетического допплера: отсутствие кровотока в сосудах акадиального плода после лазерной коагуляции.
Figure 6. Ultrasound image an echographic image using a bidirectional energy doppler: absence of blood flow in the vessels of the acadial fetus after laser coagulation.
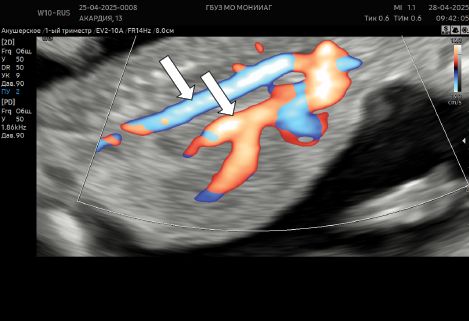
Рисунок 7а. Антеградный кровоток в систолу (указано белыми стрелками)
Figure 7a. Antegrade blood flow to the systole (indicated by white arrows)
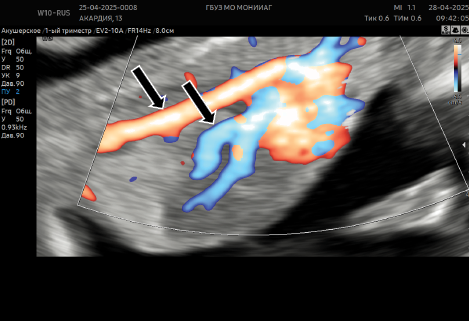
Рисунок 7б. Ретроградный кровоток в диастолу (указано черными стрелками).
Figure 7b. Retrograde blood flow to the diastole (indicated by black arrows).
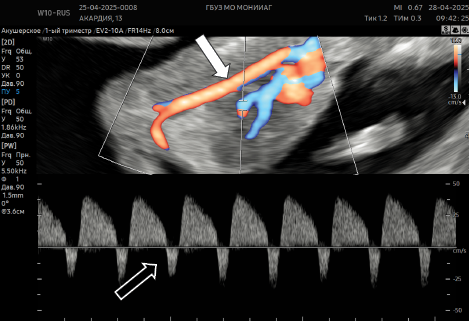
Рисунок 7в. Кривая скорости кровотока в венозном протоке плода-помпы в режиме триплексного картирования: антеградный кровоток в систолу (указано белыми стрелками), ретроградный кровоток в диастолу (указано черными стрелками).
Figure 7c. The curve of blood flow velocity in the venous duct of the fetus-pump in the triplex mapping mode: antegrade blood flow to the systole (indicated by white arrows), retrograde blood flow to the diastole (indicated by black arrows).
Заключение
Ведение и лечение синдрома обратной артериальной перфузии (СОАП) остается сложной задачей, поскольку оптимальный метод и сроки вмешательства до сих пор не определены. Несмотря на большое количество исследований, представленных в современной литературе, их неоднородность затрудняет сопоставление результатов и повышает риск систематических ошибок. Вопрос об оптимальных сроках вмешательства, при необходимости такового, остается предметом дискуссий, хотя последние исследования склоняются к предпочтительности вмешательства в первом триместре беременности. В качестве методов выбора для прекращения кровоснабжения акардиального близнеца, как правило, отдают предпочтение ультразвуковой лазерной коагуляции и радиочастотной абляции внутриплодовых сосудов.
Список литературы
1. Hrubec Z., Robinette C.D. The study of human twins in medical research. N. Engl. J. Med. 1984; 310(7): 435-41.
2. Baergen N.R. Manual of pathology of the human placenta. 2nd ed. Springer; 2011.
3. Yapıcıoğlu-Yıldızdaş H, Ece Ü, Sucu M, et al. Twin reversed arterial perfusion syndrome in a monochorionic monoamniotic twin pregnancy. Turk J Pediatr. 2017;59(6):724–727. https://doi.org/10.24953/turkjped.2017.06.020
4. Aldiansyah D, Lubis MP, Handayani D, et al. Twin reversed arterial perfusion sequence managed by bipolar cord coagulation and amniopatch: case report. Int J Surg Case Rep.2022;93:106893. https://doi.org/10.1016/j.ijscr.2022.106893
5. Brock CO, Johnson A. Twin reverse arterial perfusion: timing of intervention. Best Pract Res Clin Obstet Gynaecol.2022;S1521-6934(22):00045–1. https://doi.org/10.1016/j.bpobgyn.2022.03.006
6. Hanafy A., Peterson C.M. Twin-reversed arterial perfusion ( TRAP) sequence: case reports and review of literature. Aust. N. Z. J. Obstet. Gynaecol. 1997; 37(2): 187-91.
7. Tan TY, Sepulveda W. Acardiac twin: a systematic review of minimally invasive treatment modalities. Ultrasound Obstet Gynecol 2003;22(4):409–419. https://doi.org/10.1002/uog.224
8. Dashe JS, Fernandez CO, Twickler DM. Utility of Doppler velocimetry in predicting outcome in twin reversed-arterial perfusion sequence. Am J Obstet Gynecol.2001;185(1):135–139. https://doi.org/10.1067/mob.2001.113906
9. Jelin E, Hirose S, Rand L, et al. Perinatal outcome of conservative management versus fetal intervention for twin reversed arterial perfusion sequence with a small acardiac twin. Fetal Diagn Ther. 2010;27(3):138–141. https://doi.org/10.1159/000295176
10. Moore TR, Gale S, Benirschke K. Perinatal outcome of forty-nine pregnancies complicated by acardiac twinning. Am J Obstet Gynecol. 1990;163(3):907–912. https://doi.org/10.1016/0002-9378(90)91094-S
11. Wong AE, Sepulveda W. Acardiac anomaly: current issues in prenatal assessment and treatment. Prenat Diagn. 2005;25(9):796–806. https://doi.org/10.1002/pd.1269
12. Van Gemert MJC, Umur A, van den Wijngaard JPHM, VanBavel E, Vandenbussche FPHA, Nikkels PGJ. Increasing cardiac output and decreasing oxygenation sequence in pump twins of acardiac twin pregnancies. Phys Med Biol. 2005;50(3):N33.
13. Sepúlveda WH, Quiroz VH, Giuliano A, Henríquez R. Prenatal ultrasonographic diagnosis of acardiac twin. J Perinat Med. 1993;21(3):241–258. https://doi.org/10.1515/jpme.1993.21.3.241
14. Lewi L, Valencia C, Gonzalez E, Deprest J, Nicolaides KH. The outcome of twin reversed arterial perfusion sequence diagnosed in the first trimester. Am J Obstet Gynecol. 2010;203(3):213.e1–213.e4. https://doi.org/10.1016/j.ajog.2010.04.018
15. Pagani G, D’Antonio F, Khalil A, Papageorghiou A, Bhide A, Thilaganathan B. Intrafetal laser treatment for twin reversed arterial perfusion sequence: cohort study and meta-analysis. Ultrasound Obstet Gynecol. 2013;42(1):6–14. https://doi.org/10.1002/uog.12495
16. Tavares de Sousa M, Glosemeyer P, Diemert A, Bamberg C, Hecher K. First-trimester intervention in twin reversed arterial perfusion sequence. Ultrasound Obstet Gynecol. 2020;55(1):47–49. https://doi.org/10.1002/uog.20860
17. Roethlisberger M, Strizek B, Gottschalk I, et al. Firsttrimester intervention in twin reversed arterial perfusion sequence: does size matter? Ultrasound Obstet Gynecol. 2017;50(1):40–44. https://doi.org/10.1002/uog.16013
18. Simpson PC, Trudinger BJ, Walker A, Baird PJ. The intrauterine treatment of fetal cardiac failure in a twin pregnancy with an acardiac, acephalic monster. Am J Obstet Gynecol. 1983;147(7):842–844. https://doi.org/10.1016/0002-9378(83)90056-X
19. Ash K, Harman CR, Critter H. TRAP sequence—Successful outcome with indomethacin treatment. Obstet Gynecol. 1990;76(5 Pt 2):960–962.
20. Platt LD, DeVore GR, Bieniarz A, Benner P, Rao R. Antenatal diagnosis of acephalus acardia: a proposed management scheme. Am J Obstet Gynecol. 1983;146(7):857–859. https://doi.org/10.1016/0002-9378(83)91090-6
21. Vitucci A., Fichera A., Fratelli N., Sartori E., Prefumo F. Twin Reversed Arterial Perfusion Sequence: Current Treatment Options. Int J Womens Health. 2020 May 28;12:435–443. https://doi.org/10.2147/IJWH.S214254
22. Hamada H, Okane M, Koresawa M, Kubo T, Iwasaki H. Fetal therapy in utero by blockage of the umbilical blood flow of acardiac monster in twin pregnancy. Acta Obstet Gynaecol Jpn. 1989;41(11):1803–1809.
23. McCurdy CM, Childers JM, Seeds JW. Ligation of the umbilical cord of an acardiac-acephalus twin with an endoscopic intrauterine technique. Obstet Gynecol. 1993;82(4 Pt 2 Suppl):708–711.
24. Foley MR, Clewell WH, Finberg HJ, Mills MD. Use of the Foley Cordostat grasping device for selective ligation of the umbilical cord of an acardiac twin: a case report. Am J Obstet Gynecol. 1995;172(1 Pt 1):212–214. https://doi.org/10.1016/0002-9378(95)90117-5
25. Tan TYT, Sepulveda W. Acardiac twin: a systematic review of minimally invasive treatment modalities. Ultrasound Obstet Gynecol. 2003;22(4):409–419. https://doi.org/10.1002/uog.224
26. Rodeck C, Deans A, Jauniaux E. Thermocoagulation for the early treatment of pregnancy with an acardiac twin. N Engl J Med. 1998;339(18):1293–1295. https://doi.org/10.1056/NEJM199810293391805
27. Holmes A, Jauniaux E, Rodeck C. Monopolar thermocoagulation in acardiac twinning. Br J Obstet Gynaecol. 2001;108(9):1000–1002.
28. Hecher K, Lewi L, Gratacos E, Huber A, Ville Y, Deprest J. Twin reversed arterial perfusion: fetoscopic laser coagulation of placental anastomoses or the umbilical cord. Ultrasound Obstet Gynecol. 2006;28(5):688–691. https://doi.org/10.1002/uog.3816
29. Nicolini U, Poblete A, Boschetto C, Bonati F, Roberts A. Complicated monochorionic twin pregnancies: experience with bipolar cord coagulation. Am J Obstet Gynecol. 2001;185(3):703–707. https://doi.org/10.1067/mob.2001.117190
30. Ville Y, Hyett JA, Vandenbussche FPHA, Nicolaides KH. Endoscopic laser coagulation of umbilical cord vessels in twin reversed arterial perfusion sequence. Ultrasound Obstet Gynecol. 1994;4(5):396–398. https://doi.org/10.1046/j.1469-0705.1994.04050396.x
31. Arias F, Sunderji S, Gimpelson R, Colton E. Treatment of acardiac twinning. Obstet Gynecol. 1998;91(5 Pt 2):818–821. https://doi.org/10.1016/s0029-7844(97)00708-4
32. Quintero RA, Muñoz H, Pommer R, Diaz C, Bornick PW, Allen MH. Operative fetoscopy via telesurgery. Ultrasound Obstet Gynecol. 2002;20(4):390–391. https://doi.org/10.1046/j.1469-0705.2002.00809.x
33. Sepulveda W, Bower S, Hassan J, Fisk NM. Ablation of acardiac twin by alcohol injection into the intra-abdominal umbilical artery. Obstet Gynecol. 1995;86(4 Pt 2):680–681. https://doi.org/10.1016/0029-7844(95)00171-M
34. Jolly M, Taylor M, Rose G, Govender L, Fisk NM. Interstitial laser: a new surgical technique for twin reversed arterial perfusion sequence in early pregnancy. Br J Obstet Gynaecol. 2001;108(10):1098–1102.
35. Sepulveda W, Hasbun J, Dezerega V, Devoto JC, Alcalde JL. Successful sonographically guided laser ablation of a large acardiac twin at 26 weeks’ gestation. J Ultrasound Med. 2004;23(12):1663–1666. https://doi.org/10.7863/jum.2004.23.12.1663
36. Tsao KJ, Feldstein VA, Albanese CT, et al. Selective reduction of acardiac twin by radiofrequency ablation. Am J Obstet Gynecol. 2002;187(3):635–640. https://doi.org/10.1067/mob.2002.125242
37. Cabassa P, Fichera A, Prefumo F, et al. The use of radiofrequency in the treatment of twin reversed arterial perfusion sequence: a case series and review of the literature. Eur J Obstet Gynecol Reprod Biol. 2013;166(2):127–132. https://doi.org/10.1016/j.ejogrb.2012.10.009
38. Lee H, Bebbington M, Crombleholme TM. The North American fetal therapy network registry data on outcomes of radiofrequency ablation for twin-reversed arterial perfusion sequence. Fetal Diagn Ther. 2013;33(4):224–229. https://doi.org/10.1159/000343223
39. Chaveeva P, Poon LC, Sotiriadis A, Kosinski P, Nicolaides KH. Optimal method and timing of intrauterine intervention in twin reversed arterial perfusion sequence: case study and meta-analysis. Fetal Diagn Ther. 2014;35(4):267–279. https://doi.org/10.1159/000358593
40. Zhang ZT, Yang T, Liu CX, Li N. Treatment of twin reversed arterial perfusion sequence with radiofrequency ablation and expectant management: a single center study in China. Eur J Obstet Gynecol Reprod Biol. 2018;225:9–12. https://doi.org/10.1016/j.ejogrb.2018.03.046
41. Scheier M, Molina FS. Outcome of twin reversed arterial perfusion sequence following treatment with interstitial laser: a retrospective study. Fetal Diagn Ther. 2012;31(1):35–41. https://doi.org/10.1159/000334156
42. Ярыгина Т.А., Классен А.А., Трифонова Е.В., Батаева Р.С. Монохориальная двойня с близким прикреплением пуповин к плаценте (обзор литературы и клинические наблюдения). Ультразвуковая и функциональная диагностика. 2017;(2):25-32.
Об авторах
А. Е. ПановРоссия
Панов Антон Евгеньевич - к.м.н., заведующий отделением ультразвуковой диагностики; врач отделения ультразвуковой диагностики
101000, г. Москва, ул. Покровка, д. 22а
129327, г. Москва, ул. Ленская, д. 15
Телефон: +7 (926) 945-03-58
Д. Р. Коцуба
Россия
Коцуба Даниил Романович - врач отделения ультразвуковой диагностики
101000, г. Москва, ул. Покровка, д. 22а
Телефон: +7 (909) 698-24-12
Т. А. Ярыгина
Россия
Ярыгина Тамара Александровна - к.м.н., руководитель отделения ультразвуковой диагностики; доцент кафедры ультразвуковой диагностики факультета непрерывного медицинского образования Медицинского Института; научный сотрудник Перинатального кардиологического центра
101000, г. Москва, ул. Покровка, д. 22а
117198, г. Москва, ул. Миклухо-Маклая, 6
121552, Москва, Рублевское шоссе, д. 135
Телефон: +7 (903) 004-81-22
Рецензия
Для цитирования:
Панов А.Е., Коцуба Д.Р., Ярыгина Т.А. Синдром обратной артериальной перфузии: дискуссионные вопросы тактики ведения (обзор литературы и клиническое наблюдение). Вестник охраны материнства и младенчества. 2025;2(3):24-37. https://doi.org/10.69964/BMCC-2025-2-3-24-37
For citation:
Panov A.E., Kotsuba D.R., Yarygina T.A. Twin reversed arterial perfusion syndrome: controversial issues of management tactics (literature review and clinical observation). Bulletin of maternal and child care. 2025;2(3):24-37. (In Russ.) https://doi.org/10.69964/BMCC-2025-2-3-24-37









