Перейти к:
Современный взгляд на прогнозирование исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов при синдроме полиурии-олигурии (обзор литературы)
https://doi.org/10.69964/BMCC-2024-1-1-25-36
Аннотация
Цель. Анализ исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов, проведенный при различного рода исследованиях, опубликованных за последние годы в зарубежных и отечественных медицинских изданиях.
Материалы и методы. В обзор включены опубликованные данные за последние 10 лет. Поиск литературы проводился в базах данных Medline, Scopus, Web of Science, Google Scholar, PubMed, Wiley и Cochrane Library.
Результаты. Были определены основные ультразвуковые и фетоскопические маркеры, влияющие на исходы оперативного лечения: расположение плаценты по передней и задней стенке, место прикрепления пуповины, количество плацентарных анастомозов, аномальные кривые скоростей кровотока в артериях пуповины, расстояние между местами прикрепления пуповин, диссоциированный рост плодов, срок беременности и стадия тяжести синдрома фето-фетальной трансфузии по R. Quintero на момент проведения операции, опыт оперирующих хирургов и продолжительность операции.
Заключение. Анализ данных литературы показал, что перечисленные маркеры имеют крайне противоречивую значимость для определения прогноза выживаемости одного или обоих плодов. Дальнейшее изучение ультразвуковых и фетоскопических предикторов неблагоприятного исхода лазерной коагуляции плацентарных анастомозов позволит более взвешенно подходить к выбору оперативной тактики и персонифицированному консультированию пациенток.
Ключевые слова
Для цитирования:
Поспелова Я.Ю., Косовцова Н.В. Современный взгляд на прогнозирование исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов при синдроме полиурии-олигурии (обзор литературы). Вестник охраны материнства и младенчества. 2024;1(1):25-36. https://doi.org/10.69964/BMCC-2024-1-1-25-36
For citation:
Pospelova Ya.Yu., Kosovtsova N.V. Modern view on predicting outcomes after fetoscopic laser coagulation of placental anastomoses in polyuria-oliguria syndrome (review). Bulletin of maternal and child care. 2024;1(1):25-36. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-1-25-36
Введение
Монохориальное многоплодие продолжает оставаться одной из самых неоднозначных клинических ситуаций в акушерстве и гинекологии ХХI века. Во всем мире акушерами-гинекологами отмечается неуклонный рост числа многоплодных беременностей [1]. Факторами риска развития многоплодной беременности являются: стимуляция яичников (кломифеном или гонадотропинами), ВРТ, предыдущие многоплодные беременности, немолодой возраст матери, западноафриканское происхождение.
Частота многоплодных беременностей в естественном цикле составляет от 11 до 14 на 1000 родов, а после применения ВРТ варьирует от 1,5% до 13,2% [2].
Многоплодная беременность увеличивает риск развития: преэклампсии, гестационного сахарного диабета, послеродового кровотечения, кесарева сечения, преждевременных родов, задержки развития внутриутробных плодов/плода, мертворождения, неонатальной смертности (в основном обусловленная недоношенностью), послеродовой депрессии.
Лидирующим и тяжелым осложнением монохориальной беременности является синдром фето-фетальной трансфузии (СФФТ). Частота встречаемости синдрома трансфузии у монохориальных диамниотических двоен составляет от 10 до 15% [3-5]. Показатели летальности и заболеваемости новорожденных при СФФТ значительно выше, чем при физиологической беременности. Основными причинами ранней неонатальной смертности при синдроме трансфузии принято считать: недоношенность, синдром дыхательных расстройств, формирование кардиомиопатии, стеноз легочной артерии, неврологическая патология, тяжелая задержка роста [6][7].
Цель исследования изучение и анализ исходов беременности после проведения фетоскопической лазерной коагуляции плацентарных анастомозов и определение предикторов неблагоприятного исхода ЛКПА.
Материалы и методы
Обзор включает анализ опубликованных данных касательно факторов риска и предикторов неблагоприятного исхода ЛКПА за последние 10 лет. Поиск литературы проводился в следующих базах данных: Medline, Scopus, Web of Science, Google Scholar, PubMed, Wiley и Cochrane Library. Поиск осуществлялся по ключевым словам синдром фето-фетальной трансфузии, монохориальная диамниотическая двойня, хирургическая коррекция синдрома фето-фетальной трансфузии, перинатальные исходы. Всего по ключевым словам было найдено 120 статей, после удаления дубликатов осталось 57 статей. Далее были проанали-зированы аннотации и отобраны 56 статей, 4 из которых не включены в обзор по причине недоступности полного текста статьи. Итого в обзор включено 53 источника.
Причины развития синдрома фето-фетальной трансфузии и методы коррекции
Пусковой механизм развития синдрома трансфузии до конца не изучен. По одной из гипотез в основе СФФТ синдрома лежит патология развития плаценты плода-донора, приводящая к увеличению периферической резистентности плацентарного кровотока и к шунтированию крови к плоду-реципиенту [8-10]. Из-за уменьшения объема циркулирующей крови у плода-донора (гиповолемии) снижается конечное диастолическое давление, что приводит к уменьшению сердечного выброса крови и снижению перфузии, в дальнейшем формируется маловодие вплоть до ангидрамниона с феноменом «приклеенного» плода. Плод-реципиент компенсирует увеличение объема циркулирующей крови полиурией. В результате чего у плода-реципиента повышается преднагрузка на сердце, что увеличивает риск развития печеночной недостаточности, портальной гипертензии, асцита и, при прогрессировании данного состояния, гибели плода [11][12].
Своевременное и регулярное ультразвуковое исследование беременной женщины является основополагающим для оценки состояния плодов и диагностики СФФТ у монохориальной диамниотической двойни [13][14].
Международное общество ультразвуковой диагностики в акушерстве и гинекологии (ISUOG) в 2016 г опубликовало руководство, адресованное роли ультразвукового исследования при ведении неосложненной беременности двойней и при таких осложнениях как CФФТ, селективная задержка роста плода (СЗРП), синдром анемии-полицитемии (САП), синдром обратной артериальной перфузии (СОАП) а также в случае неразделившейся двойни или антенатальной гибели одного из плодов [15]. Ультразвуковая оценка биометрии и анатомии плодов, а также допплерография и оценка объема амниотической жидкости используется для выявления и динамического наблюдения двоен с повышенным риском неблагоприятного исхода беременностей у монохориальных диамниотических двоен с СФФТ.
Клинический протокол №31 «Тактика ведения беременности и родоразрешения при многоплодной беременности», публикованный в ноябре 2019 г, несет в себе основы диагностики, наблюдения, способах и сроках родоразрешения при многоплодных беременностях, а так же описывает способы коррекции при осложнениях характерных для монохориального многоплодия [16].
Признаки формирования синдрома трансфузии можно заподозрить при проведении УЗИ скрининга первого триместра. Ранними маркерами являются: несоответствие копчико-теменных размеров плодов (в норме — не более 5 мм), увеличение толщины воротникового пространства, отрицательный кровоток в венозном протоке [17][14][18].
Quintero R.A. одним из первых предложил классификацию синдрома фето-фетальной трансфузии, основанную на ультразвуковых изменениях параметров внутриутробных плодов [19].
- На первой стадии определяется олиго-полигидроамнион, мочевой пузырь плода-донора визуализируется;
- При второй стадии мочевой пузырь у плода-донора не визуализируется;
- Третья стадия характеризуется изменением кровотоков при допплеровском исследовании сосудов у плодов: отсутствие конечного диастолического потока в пупочной артерии у плода-донора, пульсирующий венозный поток в пупочной вене плода-реципиента.
- Четвертая стадия обусловлена выраженной водянкой плода-реципиента;
- Для пятой стадии характерно гибель одного или обоих плодов.
Наличие сосудистых плацентарных анастомозов является обязательным условием для развития СФФТ у двоен с монохориальным типом плацентации. Первое описание сосудистых анастомозов в монохориальной плаценте было представлено в трудах Stalpart van der Wiel в 1687 году. Австрийский анатом Josef Hyrtl в 1870 году создал атлас, содержащий иллюстрации монохориальных плацент с наличием в них систем глубоких и поверхностных сосудистых анастомозов. В 1882 году немецкий ученый Friedrich Schat описал клиническое значение анастомозов в системе гемоциркуляции плодов при монохориальном типе плацентации [20]. Vermelin H. в 1920 году разделил плацентарные анастомозы на глубокие и поверхностные, доказал значимость поверхностных анастомозов для поддержания адекватной гемоциркуляции плодов, а так же привел доказательство того что основной причиной гемодинамического нарушения в микроциркуляции плодов является шунтирование крови по глубоким сосудистым анастомозам плаценты [21].
Выделены три основных типа анастомозов: артерио-артериальные (АА), артерио-венозные (АВ) и вено-венозные (ВВ) [22][23]. Артерио-артериальные (АА) анастомозы расположены поверхностно и встречаются в 95% наблюдений монохориальных диамниотических плацент. Наличие таких анастомозов при СФФТ сочетается с более лучшими показателями выживаемости. Артерио-венозные анастомозы (АВ) встречаются в 95 % наблюдений монохориальных плацент, но локализуются в глубине плаценты. Считается, что именно наличие АВ анастомозов лежит в основе развития большинства осложнений при монохориальной диамниотической двойне, включая СФФТ, синдром анемии-полицитемии (САП) и диссоцированный (дискордантный) рост плодов [4][12]. Вено-венозные (ВВ) анастомозы располагаются поверхностно и встречаются примерно у 25 % монохориальных диамниотических двоен [4].
Методы коррекции напрямую зависят от стадии синдрома трансфузии и срока беременности на момент постановки диагноза. Основополагающей задачей внутриутробного оперативного вмешательства является достижение плодами границы выживаемости в состоянии, когда терапия, оказываемая новорожденным/новорожденному, позволяет ожидать их/его последующее развитие соответственно возрастным нормам.
Для коррекции СФФТ у монохориальных диамниотических двоен используются различные методы лечения: амниоредукция, септотомия, тотальная или селективная фетоскопическая лазерная коагуляция плацентарных анастомозов и коагуляция сосудов пуповины плода с худшими жизненными показателями. При выжидательной тактики или отсутствии лечения СФФТ летальность плодов составляет от 70% до 90%, а среди выживших инвалидность достигает от 4 до 31% [7][24][25].
В 1990 году J. De Lia с коллегами предложил использовать фетоскопическую лазерную коагуляцию плацентарных анастомозов, как единственный метод воздействия на причину развития СФФТ [26]. Внутриутробный доступ осуществлялся с помощью фетоскопов диаметром 3,3 мм и менее, которые используются для прямой визуализации сосудов на поверхности плаценты. После выявления анастомозов между сосудистыми сетями плода-донора и плода-реципиента производили их коагуляцию лазерной энергией, которая проводится в амниотическую полость с помощью кварцевого волокна через операционный канал фетоскопа.
Первоначально коагулировали все сосуды (неселективная лазерная коагуляция), пересекающие амниотическую мембрану [27] (рисунок 1). Позднее Quintero R.A. предложил методику селективной лазерной коагуляции плацентарных анастомозов. Коагуляцию сосудов, ветви которых не имеют анастомозов с системой циркуляции плода-донора, не проводили — это снизило число выключенных из фетоплацентарной циркуляции котиледонов, что обеспечило увеличение выживаемости плодов до 62—77% [25] (рисунок 2).
В дальнейшем была предложена «методика Соломона», суть которой заключалась в непрерывной коагуляции поверхности плаценты на отрезках, соединяющих соседние коагуляционные зоны, образовавшиеся после первого этапа, от одного до другого края плаценты. Благодаря данной техники можно коагулировать анастомозы минимального диаметра и производить полную «дихорионизацию» плаценты, тем самым снижая вероятность рецидива СФФТ [25,28] (рисунок 3).
На данный момент существует методика направленной селективной лазерной коагуляции плацентарных анастомозов. Суть которой заключается в пересечение артериовенозных анастомозов от донора к реципиенту в первую очередь, затем артериовенозных анастомозов от реципиента к донору с последующей коагуляцией оставшихся АА и ВВ анастомозов [28]. Проведение лазерной абляции в данной последовательности позволяет предотвратить сброс крови плода-донора в систему гемоциркуляции плода-реципиента непосредственно во время операции. Направленная селективная лазерная коагуляция плацентарных анастомозов способствует повышению выживаемости обоих плодов по сравнению с селективной лазерной коагуляцией (74 и 57%; p=0,005). Выживаемость хотя бы одного плода из двойни также соответственно выше (91 и 88%; p=0,005) [29] (рисунок 4).
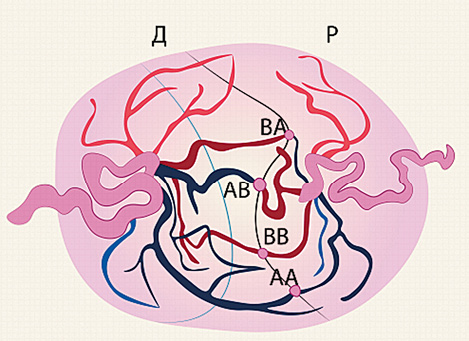
Рисунок 1. Неселективная лазерная коагуляция плацентарных анастомозов (АА — артерио-артериальный анастомоз; ВВ — вено-венозный анастомоз; АВ — артерио-венозный анастомоз; ВА — венозно-артериальный анастомоз)
Figure 1. Non-selective laser coagulation of placental anastomoses (AA — arterio-arterial anastomosis; VV — veno-venous anastomosis; AB — arteriovenous anastomosis; VA — venous-arterial anastomosis)
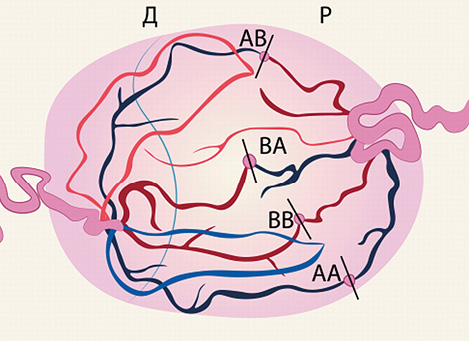
Рисунок 2. Селективная лазерная коагуляция плацентарных анастомозов (АА — артерио-артериальный анастомоз; ВВ — вено-венозный анастомоз; АВ — артерио-венозный анастомоз; ВА — венозно-артериальный анастомоз)
Figure 2. Selective laser coagulation of placental anastomoses (AA — arterio-arterial anastomosis; VV — veno-venous anastomosis; AB — arteriovenous anastomosis; VA — venous-arterial anastomosis)
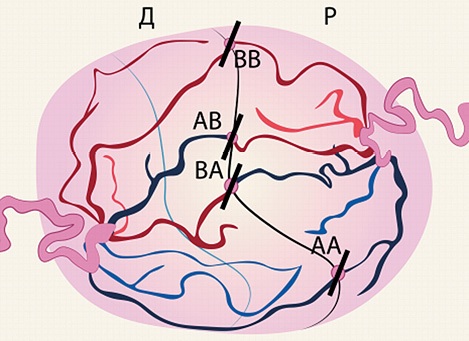
Рисунок 3. Методика Соломона (АА — артерио-артериальный анастомоз; ВВ — вено-венозный анастомоз; АВ — артерио-венозный анастомоз; ВА — венозно-артериальный анастомоз)
Figure 3. Solomon’s technique (AA — arterio-arterial anastomosis; VV — veno-venous anastomosis; AB — arteriovenous anastomosis; VA — venous-arterial anastomosis)
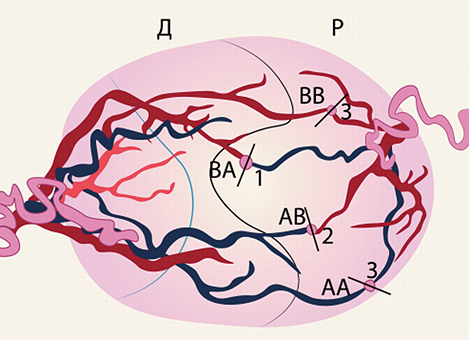
Рисунок 4. Направленная селективная лазерная коагуляция плацентарных анастомозов (АА — артерио-артериальный анастомоз; ВВ — вено-венозный анастомоз; АВ — артерио-венозный анастомоз; ВА — венозно-артериальный анастомоз)
Figure 4. Targeted selective laser coagulation of placental anastomoses (AA — arterio-arterial anastomosis; VV — veno-venous anastomosis; AB — arteriovenous anastomosis; VA — venous-arterial anastomosis)
В результате многочисленных исследований российских и зарубежных коллег, методика фетоскопической лазерной коагуляции плацентарных анастомозов — лучший способ коррекции СФФТ с наибольшим процентом выживаемости плодов и меньшими послеоперационными осложнениями для матери и плода [30-32].
Фетоскопическая лазерная коагуляция плацентарных анастомозов, несмотря на высокие показатели выживаемости и снижение заболеваемости в раннем и позднем неонатальном периоде выживших детей, несет за собой развитие интраоперационных рисков, а так же осложнений в послеоперационном периоде в отношении плодов/плода и матери [6][33]. Наиболее часто встречаемыми осложнениями после фетоскопической лазерной коагуляции плацентарных анастомозов у монохориальных диамниотических двоен являются: преждевременное излитие околоплодных вод, отслойка амниотической оболочки 20%, септотомия (разрыв межблизнецовой мембраны), формирование псевдоамниотических тяжей, рецидив СФФТ, синдром анемии-полицитемии, гибель одного или обоих плодов из двойни, зеркальный синдром (синдром Баллантайна) [34][35].
Преждевременное излитие околоплодных вод может произойти как вовремя внутриутробной коррекции синдрома трансфузии, так и в отсроченном периоде. Встречается данное осложнение с частотой 15–34%, и может приводить к ранним преждевременным родам, внутриматочному инфицированию плодов, повышая тем самым летальность и заболеваемость после проведения лазерной коагуляции плацентарных анастомозов [25][36]. В 7% случаев после внутриутробной коррекции СФФТ через пункционное отверстие в стенке матки в брюшную полость матери может произойти истечение околоплодных вод, что сопровождается маловодием у плода-реципиента [34][37]. Наряду с преждевременным излитием околоплодных вод в 5% случаев встречается отслоение амниотической оболочки в месте введения фетоскопического тубуса, которое также может провоцировать развитие ранних преждевременных родов и развитие внутриматочной инфекции [34][35].
В процессе фетосокпической коррекции СФФТ может быть повреждена межблизнецовая мембрана (интраоперационная септостомия), что сопровождается слиянием амниотических полостей плодов и увеличивает риск коллизии пуповин [38]. Остатки межамниотической мембраны могут формировать клиническую картину синдрома псевдоамниотических тяжей (СПАТ) [39]. Частота СПАТ у монохориальных близнецов после инвазивных процедур составляет от 1,8% до 3,3% [39].
Некоагулированные анастомозы малого диаметра являются причиной рецидива СФФТ. Затрудненная визуализация анастомозов может быть связана с особенностью расположения плаценты, прозрачностью околоплодных вод, особенностью расположения плодов, выраженного многоводия у плода-реципиента или маловодия у плода-донора, сроком беременности, неполной коагуляцией анастомозов с последующей их реканализацией. Возврат к дооперационному состоянию плодов встречается примерно в 18% случаев и может наблюдаться сразу после ЛКПА либо через несколько недель после внутриутробной коррекции [33]. Рецидив СФФТ после ЛКПА часть исследователей связывает с АА анастомозом, который может после проведения внутриутробной коррекции стать однонаправленным, обеспечивая сброс крови от плода-реципиента к плоду-донору [33].
Вопрос рецидивирования СФФТ остается открытым и до конца не изученным. Повторное проведение фетоскопической лазерной коагуляции плацентарных анастомозов сопряжено с высокими рисками осложнений, но в последние годы ему все больше отдают предпочтение [40]. Проведение селективной лазерной коагуляции сосудов пуповины ограничено сроком беременности, но является альтернативным методом для коррекции СФФТ при неблагоприятном прогнозе внутриутробного развития для одного плода из двойни. Серийные амниоредукции считаются паллиативным методом улучшения жизни внутриутробных плодов и не ограничены сроком беременности [32].
Предикторы, влияющие на выживаемость плодов при коррекции синдрома фето-фетальной трансфузии
В публикациях зарубежных и отечественных коллег представлены статистические данные по выживаемости плода-донора и плода-реципиента при использовании той или иной модификации ЛКПА. Крайне мало исследований посвящено вопросу предикторов выживаемости плодов, что может являться ценной информацией для выбора метода хирургического лечения СФФТ.
Hecher K. et al. c 1995 по 1999 гг. провели исследование 200 беременных с СФФТ между 16-й и 25-й неделями беременности, показатель выживаемости в данном исследовании составил 81%. В основе благоприятного исхода оперативного лечения, по мнению авторов статьи, лежит опыт хирургов, связанный с более избирательной идентификацией плацентарных анастомозов и их коагуляции [41].
Barbosa M. et al. проанализировали 24 монохориальные диамниотические двойни с диагнозом СФФТ на 18—26-й неделе беременности, где была проведена неселективная ЛКПА. Выживаемость обоих плодов составила 45,8%, одного — 87,5%. В результате отмечена прямая взаимосвязь между результатом хирургической коррекции синдрома и его стадией по Quintero R.A.: чем ниже стадия синдрома — тем лучше прогноз. По данным этих же авторов, расположение плаценты (по передней или задней стенке) на исход операции не влияло [42]. В 2021 году выходит исследование Bamberg C et al., с анализом 1020 случаев коррекции СФФТ посредствам ЛКПА, в ходе которого перинатальной выживаемости плодов при I и II стадиями синдрома СФФТ, а так же при III и IV стадиями СФФТ значимо не отличалось [32].
В 2002–2008 гг. группой ученых под руководством Cincotta R. проанализированы исходы использования селективной ЛКПА при II—IV стадиях СФФТ по Quintero R. Общая выживаемость при IV стадии синдрома СФФТ, по их данным, была значительно выше, чем при СФФТ III стадии, что противоречило выводам других исследователей [43].
Параллельно публикуются данные по эффективности проведения направленной селективной лазерной коагуляции и селективной лазерной коагуляции у монохориальных диамниотических двоен с СФФТ. Выживаемость обоих плодов была значительно выше в 1-й группе 73,7% (направленной селективной лазерной коагуляции плацентарных анастомозов), чем во 2-и группе (селективной лазерной коагуляции плацентарных анастомозов) 57,1%, при этом по выживаемости одного плода из двойни значимых различий не наблюдалось (90,5% против 87,5%). Процент гибели плодов-доноров был значительно ниже при направленной селективной лазерной коагуляции плацентарных анастомозов 7,3%, чем при селективной лазерной коагуляции плацентарных анастомозов 21,4%. Группа направленной селективной лазерной коагуляции плацентарных анастомозов ассоциируется с меньшей вероятностью внутриутробной гибели плода и увеличением числа выживших плодов по сравнению с таковыми в группе селективной лазерной коагуляции плацентарных анастомозов. Расположение плаценты, продолжительность операции и количество анастомозов, по данным исследования, не повлияли на исход лазерной коагуляции плацентарных анастомозов [44].
В 2010 г. Meriki N. et al. после ряда наблюдений предоставил данные об отсутствии корреляции между исходами ЛКПА и расположением плаценты. Выживаемость одного плода составила 90,7% (88,9% для передней и 92,1% для задней плаценты), а двух плодов — 60% [45].
В 2015 г. Snowise S. et al. провели проспективное когортное исследование с участием 166 пациенток, которым была проведена селективная ЛКПА. Послеоперационная смертность плодов-доноров составила 13%, а плодов-реципиентов — 2,6%. Авторами выделены основные причины, влияющие на неблагоприятный исход для плода-донора: задержка роста 30% и более, отсутствие конечного диастолического кровотока в артериях пуповины, аномалия прикрепления пуповины к плаценте (краевое, оболочечное), большое количество плацентарных анастомозов. Знание этих факторов риска, по мнению авторов статьи, в дальнейшем должно помочь в выборе наиболее подходящего метода лечения СФФТ [46].
Одновременно с предыдущим исследованием в 2015 г. Müllers S. et al. [47] описал 105 наблюдений ЛКПА при СФФТ. Выживаемость одного и двух плодов составила в 75% и 47% соответственно. Не обнаружено взаимосвязи между исходом оперативного лечения и гестационным сроком на момент постановки диагноза, расположением плаценты, ультразвуковыми маркерами СФФТ, хотя отмечено, что выживаемость обоих плодов значительно снижается с увеличением стадии СФФТ по Quintero R.A. [47].
«Методика Соломона», по результатам исследований многих авторов, значительно улучшила перинатальные исходы, а также снижает частоту рецидивов СФФТ [25]. В 2018 г H. Sago et al. предоставили показатели выживаемости при использовании данной методики: выживаемость обоих близнецов — 70% и одного близнеца — 90,6%. Единственным определяющим фактором успеха ЛКПА по «методике Соломона», по мнению авторов, является проведение манипуляции в сроках беременности 16—26 нед [25].
J. Stirnemann отмечает улучшение перинатальных исходов ЛКПА за период с 2000 по 2016 г. Выживаемость обоих близнецов выросла с 42 до 66%, а одного плода с 44 до 58%. Автор исследования считает, что гестационный возраст менее 17 недель беременности является неблагоприятным прогностическим фактором [38]. С противоположным мнением выступает группа ученых, L. Lecointre, D. Baud, D. Valsky, J. Espinozaкоторые не отмечают большую выживаемости одного либо двух плодов при проведении ЛКПА в сроках менее 17 нед и более 26 нед беременности [41].
При использовании метода внутриутробной коррекции по «методу Соломона» Murata S. et al. были получены следующее данные: выживаемость обоих плодов составила 74%, одного плода — 94%. В ходе исследования выявлена прямая закономерность между аномальными кривыми скорости кровотока в артериях пуповины в предоперационном периоде и высоким риском летального исхода для плода-донора после применения ЛКПА [48].
Y. Chang et al. [48] в период 2005–2014 гг. в ходе исследования выяснили, что более высокая стадия СФФТ по Quintero R. А. обусловливает меньший процент выживаемоcти плодов, аналогичные статистические данные были получены X. Liu и соавт. в 2012 г. [49].
Расстояние между пуповинами, наряду с другими факторами, играет немаловажную роль в выживаемости плодов после ЛКПА. Расстояние между местами прикрепления пуповин к плаценте от 5 см и менее затрудняет визуализацию сосудистого экватора и зону коагуляции плацентарных анастомозов, что подтверждено в работе Wang X. et al . [50].
Важность в диссоциации массы плодов описывает в своем исследовании Finneran М. et al. Наиболее частый летальный исход для плода донора отмечался при совокупности следующих показателей: диссоциированное развитие плодов, аномальные показатели кровотока в артериях пуповины у плода-донора, выявленный в дооперационном периоде [51].
Gil Guevara E. et al. в своем исследовании 86 монохориальных диамниотических двоен, осложнившихся СФФТ, установил, что основными причинами неблагоприятного исхода для плода-реципиента были аномальные кривые скоростей кровотока в венозном протоке и диссоциированное развитие плодов [52]. Кроме того, на исход влияло наличие признаков истмико-цервикальной недостаточности [29].
Стоит отметить, что использование местной и общей анестезии не дало весомых различий в исходах внутриутробной коррекции СФФТ. При использовании местной анестезии явлений дискомфорта у пациентки отсутствовало, визуализация плацентарных анастомозов была удовлетворительной. Использование миллиметровой оптики, а также уменьшение диаметра троакара с 3,8 до 2,3 мм привело к значительному улучшению исходов для новорожденных и снижению числа рецидивов СФФТ. Выживаемость одного близнеца составила 98%, обоих близнецов — 83,3% [42].
В своих работах Akkermans J. et al. [15] выявили, что мощность лазерного излучения (50 W) и величина апертурного угла оптики (90°) играют несомненную роль при проведении ЛКПА, улучшая визуализацию плацентарных анастомозов и тем самым снижая риск развития такого осложнения, как кровотечение, а также сокращают время проведения оперативного лечения.
Учеными «ФГБУ НИИ ОММ» МЗ РФ в ходе сплошного проспективного, когортного, сравнительного исследования обнаружено, что сигнальными маркерами неблагоприятного исхода ЛКПА являются: наличие отягощенного соматического статуса пациенток (хронические заболевания бронхо-легочной системы и мочевыделительного тракта), гинекологические операции на органах малого таза (гистероскопии и лапароскопии), дисбиотические нарушения микробиоты влагалища на фоне снижения местного иммунитета в дооперационном периоде [53].
Заключение
Таким образом нет единого мнения по поводу того какие именно предикторы обеспечивают наибольший процент выживаемости плодов после фетоскопической лазерной коррекции СФФТ у монохориальных диамниотических двоен. Оценка факторов риска у монохориальной диамниотической двойни, осложнившейся СФФТ, помогает лишь выбрать оптимальный способ внутриутробной коррекции.
Соматический статус пациентки, анализ биохимических показателей и инструментальных методов исследования, ультразвуковые показатели плодов помогают взвешенно подойти к вопросу проведения внутриутробной коррекции состояния плодов и в дальнейшем, учитывая предыдущий опыт, более прицельно подходить к вопросу предоперационной подготовки пациенток с СФФТ, дальнейшему вынашиванию беременности, способах и сроках родоразрешения, и дальнейшему реабилитационному периоду новорожденных в условиях многопрофильных детских стационаров.
Список литературы
1. Busnelli A., Dallagiovanna C., Reschini M., Paffoni A., Fedele L., Somigliana E. Risk factors for monozygotic twinning after in vitro fertilization: a systematic review and meta-analysis. Fertil Steril. 2019;111(2):302-317. DOI: https://doi.org/10.1016/j.fertnstert.2018.10.025
2. Song B, Wang Z, Chen Y, Wang C, Wei Z, He X, Cao Y. Repeated triplets complicated by monochorionic diamniotic twins following assisted reproduction: a case report and literature review. BMC Pregnancy Childbirth. 2020;20(1):373. DOI: https://doi.org/10.1186/s12884-020-03055-y
3. Сергеева А.В., Каткова Н.Ю., Бодрикова О.И., Ковалишена О.В., Безрукова И.М., Покусаева К.Б. Состояние влагалищного биоценоза как фактор риска возникновения различных вариантов преждевременных родов. Эпидемиология и Вакцинопрофилактика. 2020;19(1):51-57. DOI https://doi.org/10.31631/2073-3046-2020-19-1-51-57
4. Konno H., Murakoshi T., Matsushita M. The roles of superficial anastomoses in twin-twin transfusion syndrome. Placenta. 2019;82:5-9. DOI: https://doi.org/10.1016/j.placenta.2019.05.003
5. Schachter-Safrai N., Karavani G., Haj-Yahya R., Ofek Shlomai N., Porat S. Risk factors for cesarean delivery and adverse neonatal outcome in twin pregnancies attempting vaginal delivery. Acta Obstet Gynecol Scand. 2018;97(7):845-851. DOI: https://doi.org/10.1111/aogs.13333
6. Павличенко М.В., Косовцова Н.В., Зырянов М.Н., Липацев Ю.А., Маркова Т.В., Поспелова Я.Ю. Оптимизация обследования детей, перенесших фето-фетальный трансфузионный синдром. Доктор.Ру. 2021; 20(1): 50–55. DOI: https://doi.org/10.31550/1727-2378-2021-20-1-50-55
7. Gijtenbeek M., Haak M.C., Huberts T.J..P, Middeldorp J.M., Klumper F.J.C.M., Slaghekke F., Lopriore E., Oepkes D., van Klink J.M.M. Perioperative fetal hemodynamic changes in twin-twin transfusion syndrome and neurodevelopmental outcome at two years of age. Prenat Diagn. 2020;40(7):825-830. DOI: https://doi.org/10.1002/pd.5690
8. Мерц Э. Ультразвуковая диагностика в акушерстве и гинекологии // Э. Мерц. — М.: МЕДпресс-информ, 2011. — C.512-585.
9. De Paepe M.E., Shapiro S., Greco D., Luks V.L., Abellar R.G., Luks C.H., Luks F.I. Placental markers of twin-to-twin transfusion syndrome in diamniotic-monochorionic twins: A morphometric analysis of deep artery-to-vein anastomoses. Placenta. 2010;31(4):269-76. DOI: https://doi.org/10.1016/j.placenta.2009.12.024
10. Mugarab-Samedi V., Lodha A., ElSharkawy A., Al Awad E. Aplasia cutis congenita as a result of interstitial laser therapy for fetal reduction in monochorionic twins: Conservative approach and outcome. Int J Surg Case Rep. 2017;41:68-70. DOI: https://doi.org/10.1016/j.ij-scr.2017.10.007
11. Reyna-Villasmil E., Briceño-Pérez C., Briceño-Sanabria J.C. Ultrasonographic Diagnosis of Twin-to-Twin Transfusion Syndrome. Am J Perinatol. 2024;41(5):531-538. DOI: https://doi.org/10.1055/s-0042-1744259
12. Tollenaar L.S.A., Lopriore E., Faiola S., Lanna M., Stirnemann J., Ville Y., Lewi L., Devlieger R., Weingertner A.S., Favre R., Hobson S.R., Ryan G., Rodo C., Arévalo S., Klaritsch P., Greimel P., Hecher K., de Sousa M.T., Khalil A., Thilaganathan B., Bergh E.P., Papanna R., Gardener G.J., Carlin A., Bevilacqua E., Sakalo V.A., Kostyukov K.V., Bahtiyar M.O., Wilpers A., Kilby M.D., Tiblad E., Oepkes D., Middeldorp J.M., Haak M.C., Klumper F.J.C.M., Akkermans J., Slaghekke F. Post-Laser Twin Anemia Polycythemia Sequence: Diagnosis, Management, and Outcome in an International Cohort of 164 Cases. J Clin Med. 2020;5;9(6):1759. DOI: https://doi.org/10.3390/jcm9061759
13. Семенова Э.Р., Филиппова И.Г., Просвирнин И.А. Редкий случай остро развившегося фето-фетального трансфузионного синдрома с поздней манифестацией при монохориальной диамниотической двойне. Пренат. Диагн. 2018; 17(3): 276–281. DOI: https://doi.org/10.21516/2413-1458-2018-17-3-276-281
14. Lewi L. Monochorionic diamniotic twins: What do I tell the prospective parents? Prenatal Diagnosis. 2020;40:766-775. DOI: https://doi.org/10.1002/pd.5705LEWI775
15. Khalil A., Rodgers M., Baschat A., Bhide A., Gratacos E., Hecher K., Kilby M.D., Lewi L., Nicolaides K.H., Oepkes D., Raine-Fenning N., Reed K., Salomon L.J., Sotiriadis A., Thilaganathan B., Ville Y. ISUOG Practice Guidelines: role of ultrasound in twin pregnancy. Ultrasound Obstet Gynecol. 2016;47(2):247-63. DOI: https://doi.org/10.1002/uog.15821
16. Михайлов А.В., Романовский А.Н., Кузнецов А.А. Передовые клинические практики и технологии в акушерстве: клиническое руководство. Санкт-Петербург: РИЦ ПСПбГМУ; 2019: 827-853.
17. Fischbein R., Nicholas L., Aultman J., Baughman K., Falletta L. Twin-twin transfusion syndrome screening and diagnosis in the United States: A triangulation design of patient experiences. PLoS One. 2018;5;13(7):e0200087. DOI: https://doi.org/10.1371/journal.pone.0200087
18. National Guideline Alliance (UK). Evidence review for ultrasound screening for feto-fetal transfusion syndrome: Twin and Triplet Pregnancy: Evidence review A. London: National Institute for Health and Care Excellence (NICE); 2019 Sep. PMID: 35192247.
19. Quintero R.A., Morales W.J., Allen M.H., Bornick P.W., Johnson P.K., Kruger M. Staging of twin-twin transfusion syndrome. J Perinatol. 1999;19(8 Pt 1):550-5. DOI: https://doi.org/10.1038/sj.jp.7200292
20. Akkermans J., Peeters S.H., Klumper F.J., Lopriore E., Middeldorp J.M., Oepkes D. Twenty-Five Years of Fetoscopic Laser Coagulation in Twin-Twin Transfusion Syndrome: A Systematic Review. Fetal Diagn Ther. 2015;38(4):241-53. DOI: https://doi.org/10.1159/000437053
21. Mann P., Green J., Walker K. Twin-to-twin transfusion syndrome and potential applicability to the Barker hypothensis. Journal of Neonatal Nursing. 2016;78:90-123.
22. Бугеренко А.Е., Суханова Д.И., Донченко Я.С., Панина О.Б., Сичинава Л.Г. Ангиоархитектоника плаценты при синдроме фето-фетальной трансфузии у беременных с монохориальной двойней. Перинатальные исходы. Акушерство и гинекология. 2019; 5: 63-9. DOI: https://doi.org/10.18565/aig.2019.5.63-69
23. Костюков К.В., Гладкова К.А. Диагностика фето-фетального трансфузионного синдрома, синдрома анемии-полицитемии при монохориальной многоплодной беременности. Акушерство и гинекология. 2016; 1: 10-15. DOI: https://doi.org/10.18565/aig.2016.1.10-15
24. Bolch C., Fahey M., Reddihough D., Williams K., Reid S., Guzys A., Cole S., Edwards A., Fung A., Hodges R., Palma-Dias R., Teoh M., Walker S. Twin-to-twin transfusion syndrome neurodevelopmental follow-up study (neurodevelopmental outcomes for children whose twin-to-twin transfusion syndrome was treated with placental laser photocoagulation). BMC Pediatr. 2018;18(1):256. DOI: https://doi.org/10.1186/s12887-018-1230-8
25. Sago H., Ishii K., Sugibayashi R., Ozawa K., Sumie M., Wada S.. Fetoscopic laser photocoagulation for twin-twin transfusion syndrome. J Obstet Gynaecol Res. 2018 May;44(5):831-839. DOI: https://doi.org/10.1111/jog.13600
26. De Lia J.E., Cruikshank D.P., Keye W.R. Jr. Fetoscopic neodymium:YAG laser occlusion of placental vessels in severe twin-twin transfusion syndrome. Obstet Gynecol. 1990;75(6):1046-53. PMID: 2342732.
27. De Lia J., Fisk N., Hecher K., Machin G., Nicolaides K., Hyett J., Quintero R., Thilaganathan B., Ville Y. Twin-to-twin transfusion syndrome--debates on the etiology, natural history and management. Ultrasound Obstet Gynecol. 2000;16(3):210-3. DOI: https://doi.org/10.1046/j.1469-0705.2000.00266.x
28. Павличенко М. В., Косовцова Н. В.,. Маркова Т. В, Поспелова Я. Ю. Опыт применения различных методик лазерной коагуляции плацентарных анастомозов с целью купирования синдрома фето-фетальной трансфузии у монохориальных диамниотических двоен. Уральский медицинский журнал. — 2021;20(3):4-13. DOI: https://doi.org/10.52420/20715943-2021-20-3-4-13
29. Rüegg L., Hüsler M., Krähenmann F., Natalucci G., Zimmermann R., Ochsenbein-Kölble N. Outcome after fetoscopic laser coagulation in twin-twin transfusion syndrome — is the survival rate of at least one child at 6 months of age dependent on preoperative cervical length and preterm prelabour rupture of fetal membranes? J Matern Fetal Neonatal Med. 2020;33(5):852-860. DOI: https://doi.org/10.1080/14767058.2018.1506441
30. Башмакова Н.В., Айтов А.Э., Косовцова Н.В., Чистякова Г.Н., Ремизова И.И. Оценка эффективности фетоскопической лазерной коагуляции плацентарных анастомозов у женщин, беременных монохориальной диамниотической двойней. Доктор.Ру. 2021; 20(1): 33–37. DOI: https://doi.org/10.31550/1727-2378-2021-20-1-33-37
31. Бугеренко А.Е. Синдром фето-фетальной трансфузии. Пятнадцатилетний опыт фетоскопического лечения. Вопросы гинекологии, акушерства и перинатологии.2021;5(20):58-62. DOI: https://doi.org/10.20953/1726-1678-2021-5-58-62
32. Bamberg C., Hecher K. Update on twin-to-twin transfusion syndrome. Best Pract Res Clin Obstet Gynaecol. 2019;58:55-65. DOI: https://doi.org/10.1016/j.bpobgyn.2018.12.011
33. Маркова Т.В., Косовцова Н.В., Куклин Е.С., Павличенко М.В., Поспелова Я.Ю. Современные представления о синдроме анемии-полицитемии при монохориальном многоплодии (TAPS). Акушерство и гинекология. 2019;7:24-29. https://doi.org/10.18565/aig.2019.7.24-29
34. Михайлов А.В., Романовский А.Н., Кузнецов А.А., Каштанова Т.А., Шлыкова А.В., Кянксеп А.В., Мовчан В.Е. Основные осложнения операции фетоскопической лазерной коагуляции анастомозов плаценты при фето-фетальном трансфузионном синдроме. Таврический медико-биологический вестник. 2018;2 (21) : 189-194.
35. Li W.F., Chao A.S., Chang S.D., Cheng P.J., Yang L.Y., Chang Y.L. Effects and outcomes of septostomy in twin-to-twin transfusion syndrome after fetoscopic laser therapy. BMC Pregnancy Childbirth. 2019;19(1):397. DOI: https://doi.org/10.1186/s12884-019-2555-5
36. Zhang L.Y., Wei X., Zou G., Yang Y.J., Zhou F.H., Chen J.P., Zhou Y., Sun L.M. Perioperative maternal complications of twin-twin transfusion syndrome after fetoscopic laser photocoagulation. Zhonghua Fu Chan Ke Za Zhi. 2020; 25;55(12):823-829.DOI: https://doi.org/10.3760/cma.j.cn112141-20200821-00656
37. Stirnemann J., Djaafri F., Kim A., Mediouni I., Bussieres L., Spaggiari E., Veluppillai C., Lapillonne A., Kermorvant E., Magny J.F., Colmant C., Ville Y. Preterm premature rupture of membranes is a collateral effect of improvement in perinatal outcomes following fetoscopic coagulation of chorionic vessels for twin-twin transfusion syndrome: a retrospective observational study of 1092 cases. BJOG. 2018; 125(9):1154-1162. https://doi.org/10.1111/1471-0528.15147
38. Бугеренко А.Е., Щербакова Л.Н., Панина О.Б. Септостомия во время фетоскопической лазерной коагуляции сосудистых анастомозов при синдроме фето-фетальной трансфузии. Гинекология. 2021;4 : 324–329 https://doi.org/10.26442/20795696.2021.4.200842
39. Gueneuc A., Chalouhi G.E., Borali D., Mediouni I., Stirnemann J., Ville Y. Fetoscopic Release of Amniotic Bands Causing Limb Constriction: Case Series and Review of the Literature. Fetal Diagn Ther. 2019;46(4):246-256. https://doi.org/10.1159/000495505
40. Михайлов А.В., Романовский А.Н., Овсянников Ф.А. Повторное применение фетоскопической лазерной коагуляции анастомозов плаценты при рецидиве фето-фетального трансфузионного синдрома. Трансляционная медицина.2018;3:66-69. https://doi.org/10.18705/2311-4495-2018-5-3-66-69
41. Hecher K., Diehl W., Zikulnig L., Vetter M., Hackelöer B.J. Endoscopic laser coagulation of placental anastomoses in 200 pregnancies with severe mid-trimester twin-to-twin transfusion syndrome. Eur J Obstet Gynecol Reprod Biol. 2000;92(1):135-9. https://doi.org/10.1016/s0301-2115(00)00437-1
42. Barbosa M.M., Martins Santana E.F., Milani H.J.F., Elito Júnior J., Araujo Júnior E., Moron A.F., Nardozza L.M.M. Fetoscopic laser photocoagulation for twin-to-twin transfusion syndrome treatment: initial experience in tertiary reference center in Brazil. Obstet Gynecol Sci. 2018;61(4):461-467. https://doi.org/10.5468/ogs.2018.61.4.461
43. Cincotta R.B., Gray P.H., Gardener G., Soong B., Chan F.Y. Selective fetoscopic laser ablation in 100 consecutive pregnancies with severe twin-twin transfusion syndrome. Aust N Z J Obstet Gynaecol. 2009;49(1):22-7. https://doi.org/10.1111/j.1479-828X.2008.00942.x
44. Nakata M., Murakoshi T., Sago H., Ishii K., Takahashi Y., Hayashi S., Murata S., Miwa I., Sumie M., Sugino N. Modified sequential laser photocoagulation of placental communicating vessels for twin-twin transfusion syndrome to prevent fetal demise of the donor twin. J Obstet Gynaecol Res. 2009;35(4):640-7. https://doi.org/10.1111/j.1447-0756.2009.01034.x
45. Meriki N., Smoleniec J., Challis D., Welsh A.W. Immediate outcome of twin-twin transfusion syndrome following selective laser photocoagulation of communicating vessels at the NSW Fetal Therapy Centre. Aust N Z J Obstet Gynaecol. 2010;50(2):112-9. https://doi.org/10.1111/j.1479-828X.2009.01127.x
46. Snowise S., Moise K.J., Johnson A., Bebbington M.W., Papanna R. Donor Death After Selective Fetoscopic Laser Surgery for Twin-Twin Transfusion Syndrome. Obstet Gynecol. 2015;126(1):74-80. https://doi.org/10.1097/AOG.0000000000000858
47. Müllers S.M., McAuliffe F.M., Kent E., Carroll S., Mone F., Breslin N., Dalrymple J., Mulcahy C., O’Donoghue K., Martin A., Malone F.D. Outcome following selective fetoscopic laser ablation for twin to twin transfusion syndrome: an 8 year national collaborative experience. Eur J Obstet Gynecol Reprod Biol. 2015;191:125-9. https://doi.org/10.1016/j.ejogrb.2015.05.019
48. Murata S., Takano M., Kagawa Y., Sumie M., Nakata M. The experience of modified sequential selective laser photocoagulation of communicating vessels technique for twin-twin transfusion syndrome. J Matern Fetal Neonatal Med. 2018;31(9):1137-1141. https://doi.org/10.1080/14767058.2017.1311309
49. Liu X.X., Lau Tk., Wang H.F., Wong Sm., Leung Ty. [Fetoscopic guided laser occlusion for twin-to-twin transfusion syndrome in 33 cases]. Zhonghua Fu Chan Ke Za Zhi. 2012;47(8):587-91. Chinese. PMID: 23141178.
50. Wang X., Li L., Zhao Y., Wei Y., Yuan P. Longer distance between umbilical cord insertions is associated with spontaneous twin anemia polycythemia sequence. Acta Obstet Gynecol Scand. 2021;100(2):229-234. https://doi.org/10.1111/aogs.13991
51. Finneran M.M., Templin M.A., Stephenson C.D. Risk of donor demise after laser therapy for twin-twin transfusion when complicated by growth discordance and abnormal umbilical artery Doppler findings. J Matern Fetal Neonatal Med. 2019;32(8):1332-1336. https://doi.org/10.1080/14767058.2017.1404983
52. Gil Guevara E., Pazos A., Gonzalez O., Carretero P., Molina F.S. Doppler assessment of patients with twin-to-twin transfusion syndrome and survival following fetoscopic laser surgery. Int J Gynaecol Obstet. 2017;137(3):241-245. https://doi.org/10.1002/ijgo.12143
53. Косовцова Н.В., Поспелова Я.Ю., Маркова Т.В., Павличенко М.В., Гришкина А.А. Роль инфекционного фактора при преждевременном излитии околоплодных вод после лазерной коагуляции плацентарных анастомозов у монохориальных двоен при синдроме фето-фетальной трансфузии. Российский вестник акушера-гинеколога. 2023;23(2):11–18. DOI: https://doi.org/10.17116/rosakush20232302111
Об авторах
Я. Ю. ПоспеловаРоссия
Поспелова Яна Юрьевна — кандидат медицинских наук, врач ультразвуковой диагностики.
ул. Репина, д. 1, Екатеринбург, 620028
Телефон: +7 (922) 142-13-31
Н. В. Косовцова
Россия
Косовцова Наталья Владимировна — доктор медицинских наук, руководитель отдела биофизических методов исследования, врач высшей категории.
ул. Репина, д. 1, Екатеринбург, 620028
Телефон: +7 (912) 26-59-169
Рецензия
Для цитирования:
Поспелова Я.Ю., Косовцова Н.В. Современный взгляд на прогнозирование исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов при синдроме полиурии-олигурии (обзор литературы). Вестник охраны материнства и младенчества. 2024;1(1):25-36. https://doi.org/10.69964/BMCC-2024-1-1-25-36
For citation:
Pospelova Ya.Yu., Kosovtsova N.V. Modern view on predicting outcomes after fetoscopic laser coagulation of placental anastomoses in polyuria-oliguria syndrome (review). Bulletin of maternal and child care. 2024;1(1):25-36. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-1-25-36









