Перейти к:
Изменения микробиома у женщин с гестационным сахарным диабетом (обзор литературы)
https://doi.org/10.69964/BMCC-2024-1-3-42-52
Аннотация
Введение. Гестационный сахарный диабет (ГСД) — это распространенное заболевание, которое в последнее время привлекает особое внимание из-за нежелательных последствий для здоровья как женщин, так и их детей. Применяются новые подходы для разработки стратегий, которые предотвращают ГСД и его последствия. Один из таких подходов заключается в оценке изменений микробиома.
Цель. Обобщение современных научных представлений о связи состава микробиоты матери с ГСД и обсуждение возможности управления ГСД с использованием микробиома.
Материалы и методы. Был проведён обширный обзор литературы с использованием базы данных MEDLINE (PubMed) по состоянию на декабрь 2024 года с использованием ключевых слов и фильтра: рандомизированное контролируемое исследование, метаанализ, систематический обзор.
Результаты. В этом обзоре суммированы основные данные о влиянии состава и разнообразия микробиоты на возникновение и развитие ГСД. Хотя были некоторые несоответствия среди результатов, была замечена картина значительных изменений в кишечном, оральном, вагинальном микробиоме женщин с ГСД. В частности, обилие определенных кишечных бактерий связано с повышенным риском развития ГСД, в то время как другие изменения в микробиоме могут быть связаны с улучшением чувствительности к инсулину. Кроме того, изменения в микробиоте кишечника могут влиять на контроль уровня глюкозы в крови с помощью различных механизмов, включая выработку короткоцепочечных жирных кислот, активацию воспалительных путей и метаболизм витаминов группы В.
Заключение. Существует четкая корреляция между ГСД и микробными сообществами, где определенные закономерности изменений микробиома наблюдались в желудочно-кишечном и репродуктивном трактах беременных женщин. Эти результаты, хотя и имеют некоторые ограничения, являются многообещающими и обнадеживающими для разработки стратегий, нацеленных на модулцию микробиома человека, с целью разработки новых терапевтических планов для лечения или профилактики ГСД с использованием пробиотиков и парабиотиков следующего поколения. Будущие исследования должны оценить результаты и эффективность таких терапевтических методов.
Для цитирования:
Гайфуллина О.В., Дерябина Е.Г., Мелкозерова О.А. Изменения микробиома у женщин с гестационным сахарным диабетом (обзор литературы). Вестник охраны материнства и младенчества. 2024;1(3):42-52. https://doi.org/10.69964/BMCC-2024-1-3-42-52
For citation:
Gaifullina O.V., Deryabina E.G., Melkozerova O.A. Microbiome alterations in women with gestational diabetes mellitus (literature review). Bulletin of maternal and child care. 2024;1(3):42-52. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-3-42-52
Введение
Гестационный сахарный диабет (ГСД) представляет собой серьезную медико-социальную проблему, так как в значительной степени увеличивает частоту нежелательных исходов беременности [1-6]. В последнее время особое внимание уделяется оценке роли микробиоты в возникновении заболевания и для достижения наилучших результатов его лечения [7][8].
Под микробиотой понимают совокупность микроорганизмов, которые находятся на слизистых поверхностях и коже в симбиотическом взаимодействии. Например, в кишечнике обитает около 100 триллионов бактерий, архей, вирусов и эукариотических микробов, которые колонизируют в основном дистальный отдел толстой кишки [9]. Вагинальная, оральная, респираторная и маточная микробиота также являются основными компонентами слизистых поверхностей [10].
Считается, что человеческий микробиом вносит вклад в различные физиологические и патологические механизмы. Иммуномодуляция хозяина, защита от патогенных бактерий путем предотвращения их прикрепления к слизистым поверхностям, пищеварение, метаболизм, производство и извлечение питательных веществ и витаминов для поглощения эпителиальными клетками — вот некоторые из предполагаемых функций человеческого кишечного микробиома [1][6][7][10][11].
Особое внимание в последнее время уделяется изучению связи микробных сообществ женского организма с развитием ГСД. Было отмечено, что во время беременности микробиом претерпевает некоторые изменения, особенно в желудочно-кишечном, и урогенитальном трактах [12][13]. Это порождает множество вопросов относительно связи между ГСД и микробиотой, возможности разработки стратегий управления для профилактики или лечения ГСД с использованием подходов, модулирующих человеческий микробиом.
Исследования пришли к выводу о связи между человеческим микробиомом и различными патологиями, такими как метаболический синдром и его компоненты, включая ожирение, гипергликемию и резистентность к инсулину [14][15]. Были предложены различные интерпретации роли микробиоты в механизмах, лежащих в основе этих патологий. Например, считается, что микробиота вызывает ожирение посредством ферментации пищевых волокон и вызывая перепроизводство короткоцепочечных жирных кислот (КЦЖК) [16]. Кроме того, считается, что измененный микробиом вызывает резистентность к инсулину посредством формирования слабовыраженного воспаления, инициированного липополисахаридами (ЛПС), которые заметно увеличиваются у пациентов, потребляющих пищу с высоким содержанием жиров [1].
Целью этого обзора явилось обобщение современных научных представлений о связи состава микробиоты матери с ГСД и обсуждение возможности управления ГСД с использованием микробиома.
Материалы и методы
Был проведён обширный обзор литературы с использованием базы данных MEDLINE (PubMed) по состоянию на ноябрь 2024 года с использованием ключевых слов: «гестационный сахарный диабет», «микробиом», «микробиота» и фильтра: рандомизированное контролируемое исследование, метаанализ, систематический обзор. Дополнительные ресурсы были определены с использованием списков литературы полученных статей.
Микробиом у женщин с ГСД
Симбиотическая микрофлора человека и продукты ее жизнедеятельности, участвуют в защите организма от патогенов, поддержании иммунитета, обеспечивают производство важных компонентов питания [6]. Вместе со всеми системами организма микробиом претерпевает изменения во время беременности. Хотя до сих пор не совсем ясно, являются ли эти изменения нормальным следствием физиологических реакций, происходящих во время беременности, или независимым проявлением, которое играет свою собственную роль в содействии физиологическому состоянию, похоже, что микробные сообщества проявляют уникальную модель во время гестационного периода. В настоящее время известно, что нарушения микробиома могут приводить к развитию сахарного диабета, и обнаружены прямые взаимосвязи между представителями кишечного микробиоценоза и уровнем инсулина, триглицеридов и липопротеинов очень низкой плотности (Таблица 1) [7]. В нашем исследовании мы в основном фокусируемся на изменениях микробиома при ГСД, где было обнаружено, что он проявляет специфическую сигнатуру в случаях ГСД по сравнению с нормальными группами.
Как правило, изменение микробиома связано с гормональными, иммунологическими и метаболическими изменениями [17]. Эти изменения выражаются в сдвиге в микробном составе, проявляющемся в изменении α- и β-разнообразия, которые измеряют в качественном и количественном соотношении представителей микробиома в одном и том же образце и среди различных сообществ соответственно [18].
Качественное и количественное изменение микробного состава последовательно приводит к функциональным изменениям в организме. Sheng Ma с соавторами [19] приводят патогенетические механизмы взаимодействия экзогенных факторов в аспекте развития ГСД (Рисунок 1). Продемонстрированы данные о том, что кишечная микробиота оказывает множественное регулирующее воздействие на ГСД, в частности, вырабатываемые ею метаболиты вызывают резистентность к инсулину, инициируя воспалительную реакцию.
Следует отметить, что ГСД может оставлять определенные следы в микробиоме женщины, где продольные исследования показали, что микробиом остается измененным даже в течение нескольких месяцев после родов [20].
Микробиом кишечника у женщин с ГСД
Во многих исследованиях было продемонстрировано изменение микробиома кишечника во время беременности в сторону сообществ, вырабатывающих энергию и способствующих росту плода, таких как Bacillota или типы Pseudomonadota и Actinomycetota, которые оказывают провоспалительное действие, обеспечивая защиту от инфекций [11][21][22].
В микробиоме кишечника женщин с ГСД наблюдались значительные изменения в филумах Bacillota, Bacteroidota, Actinomycetota, Pseudomonadota, Verrucomicrobiota, Fusobacteriota и других (Рисунок 2) [22]. Основные изменения были приписаны филумам Bacillota и Bacteroidota, где они были обогащены в большинстве исследований, хотя в некоторых исследованиях было отмечено снижение их численности. Вклад Bacillota (бактерий, продуцирующих бутират) и Bacteroidota (бактерий, продуцирующих ацетат и пропионат) в образование короткоцепочечных жирных кислот и впоследствии в адипогенез подтверждает идею о том, что их изменение может играть роль в ожирении и резистентности к инсулину у женщин с ГСД [1]. Ожирение и нарушение толерантности к глюкозе обычно связаны с увеличением количества бактерий филумом Bacillota [23][24].
Уменьшение количества Bifidobacterium spp., как представителей нормального микробиоценоза кишечника человека, продуцирующих ацетат и лактат, также наблюдалось у женщин с ГСД. Это изменение можно объяснить известной ролью Bifidobacterium spp.в ферментативном метаболизме, деградации углеводов и внутриклеточном поглощении коротких олигосахаридов [25].
Более того, значительное увеличение рода Blautia было общим результатом различных исследований, что интересно из-за уже доказанной связи между этим родом и непереносимостью глюкозы, метаболическими нарушениями и индексом массы тела ( ИМТ) [23].
Prevotella — еще один род, количество представителей которого, как было обнаружено, в целом, увеличивается в кишечнике женщин с ГСД. Было высказано предположение, что этот род играет роль в изменении проницаемости кишечника, вызывая разрушение олигосахаридов муцина и вызывая резистентность к инсулину [26][27].
Роль изменений микробиоты кишечника можно объяснить либо увеличением выработки энергии из потребляемой пищи, либо ремоделированием метаболических и воспалительных интерактивных путей между хозяином и микробиомом. Это проявляется в его ассоциации с увеличением веса, ожирением, резистентностью к инсулину, гипергликемией и воспалением низкой степени к поздней фазе беременности в третьем триместре, что достигается за счет увеличения абсорбции глюкозы и жирных кислот, а также за счет усиления катаболических путей [28].
Микробиом полости рта у беременных с ГСД
Микробиом кишечника подвергается изменениям в соответствии с различными метаболическими состояниями, микробиом полости рта также претерпевает схожие изменения. Известно, что полость рта является местом проживания широкого спектра микробных сообществ из-за воздействия на этот тракт многих факторов, включая возраст, диету, гигиену, заболевания полости рта, такие как пародонтит, гингивит и кариес зубов, гематологическое распространение, связь с внешней средой и, в меньшей степени, с сексуальной активностью [29-31]. Микробиоценоз полости рта в в большей части представлен представителями Streptococcus spp., а присутствие некоторых других бактерий различается в зависимости от участка полости рта, где Actinomyces spp. в основном обитают в наддесневом налете, в то время как в поддесневом налете в основном преобладает Prevotella spp. [31].
Эти микробные сообщества находятся в симбиотических отношениях с хозяином в нормальном стандартном физиологическом состоянии, где в нестерильном локусе организма хозяина формируются условия для размножения бактерий, которые участвуют в обеспечении здорового состояния полости рта [30]. Патологические изменения могут нарушить нормальный микробный состав.
Микробиом слюны у беременных с ГСД
Изменения обычно наблюдаются и во время беременности, когда происходит сдвиг в сторону более разнообразного и обогащенного микробиома. К третьему триместру беременности в микробиоме слюны было замечено увеличение A. actinomycetemcomitans, S. mutans, P. gingivalis и P. intermedia. Что касается изменений микробиома полости рта у женщин с ГСД, результаты были не такими краткими по сравнению с изменениями микробиома кишечника.
Была отмечена разрозненная картина изменений микробных сообществ, где наблюдалось уменьшение количества оральных стрептококков, лактобацилл и бифидобактерий и увеличение количества актиномицетов, руминококковых и энтеробактерий среди других родов. Уменьшение количества лактобацилл может иметь некоторые негативные последствия для здоровья полости рта, поскольку эти бактерии известны своей продукцией полезных органических кислотных лактатов [32]. Хотя эта картина изменений не очень специфична, она демонстрирует корреляцию между ГСД и составом микробиоты полости рта, хотя механизм, посредством которого эти бактерии связаны с ГСД, еще не полностью изучен.
Вагинальный микробиом у женщин с ГСД
Вагинальный микробиом представляет собой совокупность полезных микроорганизмов, которые играют свою собственную роль в поддержании здорового состояния вагинального тракта, особенно из-за важности этого тракта в репродуктивных функциях и его связи с рождением плода в дальнейшем.
По сравнению с другими микробиомами, вагинальный микробиом выражает менее сложный состав, при этом род Lactobacillus spp. преобладает в микробном сообществе с частотой около 70% [29]. Как и другие полезные микробные сообщества, Lactobacillus spp., как полагают, выполняет защитную функцию, устраняя нежелательные эффекты патологических микробных агентов через кислую среду, создаваемую выработкой молочной кислоты [21].
На микробиом влагалища влияют различные факторы, включая гормональные изменения во время репродуктивных циклов женщин, гигиену и сексуальную активность, и во время беременности он демонстрирует определенную картину, при которой происходит обогащение такими бактериями как Lactobacillus spp., Eubacteriales, Bacteroides spp. и Actinomycetales. При оценке изменений микробиома влагалища у женщин с ГСД Lactobacillus listeri, Lactobacillus amylovorus и Lactobacillus fructivorans были значительно связаны с ГСД. Другие роды также были обогащены во влагалищных трактах женщин с ГСД, включая Bacteroides spp., Veillonella spp., Enterococcus spp., Enterobacter spp., Fusobacterium spp. и Prevotella spp. среди других.
Известно, что дисбактериоз влагалища делает женщин, страдающих ГСД, уязвимыми для патологических состояний, ассоциированных с неблагоприятными исходами беременности, таким как преждевременные роды и преждевременный разрыв плодных оболочек [21]. Вполне возможно, что эти изменения, происходящие одновременно с наличием ГСД, могут оказывать влияние на здоровье женщин и их потомства, что в большей мере характерно для тех детей, которые рождаются путем нормальных вагинальных родов, что необходимо изучить в будущих исследованиях.
Плацентарный микробиом у беременных с ГСД
Плацента, являющаяся важнейшим связующим звеном между беременными женщинами и их плодами, была оценена некоторыми исследованиями, и было обнаружено, что она в норме содержит некоторые непатогенные бактерии, включая Mycoplasmatota, Fusobacteriota, Bacteroidota и Bacillota [8][33]. В плацентарном микробиоме случаев ГСД, несмотря на неоднородность среди случаев, включенных в исследования, были отмечены изменения в филумах Pseudomonadota, Bacteroidota, Actinomycetota и Bacillota. Например, было отмечено более низкое количество Acinetobacter spp., что коррелирует с метаболическим и воспалительным состоянием [34].
Между тем, в другом исследовании плацентарный микробиом в случаях ГСД выразил повышенное разнообразие и повышенную экспрессию Ruminococcus spp., и Coprococcus spp., которые участвуют в фосфорилировании целлобиозы и глюкозы, а также в ферментации полисахаридов и продукции SCFAs соответственно [35]. То, как на микробиом плаценты влияет статус ГСД у матери, не совсем ясно, но считается, что плацента может взаимодействовать с гипергликемическим состоянием, вызванным ГСД, через воспаление и окислительный стресс или через орально-плацентарный путь через гематогенную передачу, где многие исследования доказали сходство между двумя моделями микробиома [35]. Кроме того, существует вероятность, что эти виды передаются в плаценту через вагинально-ректальный тракт, в полость матки и через лимфатическую систему матери, которая переносит микробные виды из кишечника в кровоток к плаценте [36][37].
Таблица 1. Виды микроорганизмов и их влияние на метаболические переменные при ГСД.
Table 1. Types of microorganisms and their effect on metabolic variables in gestational diabetes mellitus.
Наименова- ницы Микро- организм | Метаболический результат | Влияние на организм | |||||
Глю-коза крови | Ожи-ре-ние | Гликиро-ванный гемоглобин | Противо- воспали- тельные цитокины | Инсу-лин | Три-глице-риды | ||
Prevotellaceae | ↑ | ↑ | Нарушение проницаемости кишечной слизистой | ||||
Pseudomonadota | ↑ | ↑ | ↑ | ↑ | Защита от инфекционных агентов | ||
↑ | ↑ | Защита от инфекционных агентов | |||||
Faecalibacterium | ↑↓ | ↓ | ↓ | ↑ | Синтез бутирата, энтеропротективный эффект | ||
Bacteroidaceae | ↑ | Гидролиз углеводов, синтез ацетата и пропионата | |||||
Blautia | ↑ | ↑ | Продукция ацетата | ||||
Akkermansia | ↑ | Деградация молекул муцина | |||||
Collinsella | ↑ | Ферментация углеводов | |||||
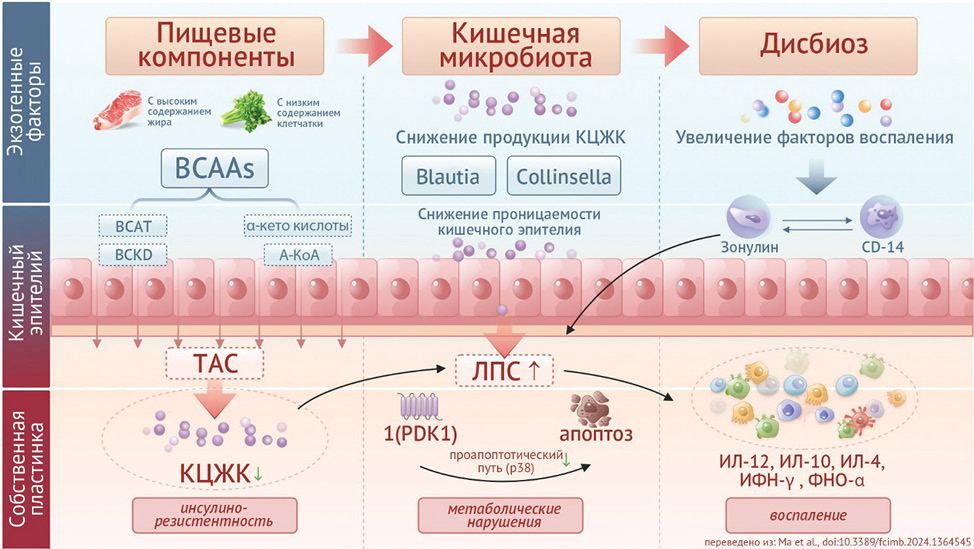
Рисунок 1. Влияние пищевых компонентов на микробиоту кишечника, липидный обмен и чувствительность к инсулину: наглядная модель патогенеза гестационного сахарного диабета [19]
BCAAs — BranchedChainAminoAcids, короткоцепочечные аминокислоты; BCAT — Branched-ChainAminotransferase, короткоцепочечная аминотрансфераза; BCKD — Branched-Chain α-KetoAcidDehydrogenase, дегидрогеназа короткоцепочечной α-кето кислоты; А-КоА — альфа кофермент А; TAC — totalantioxidantcapacity, общая антиоксидантная способность; КЦЖК — короткоцепочечные жирные кислоты; ЛПС — липополисахариды; 1(PDK1) — 3-phosphoinositide-dependent proteinkinase 1, 3-фосфоинозитид-зависимая протеинкиназа 1; ИЛ-12(10,14) — интерлейкины; ФНО — фактор некроза опухоли, ИФН — интерферон.
Figure 1. The effect of food components on the intestinal microbiota, lipid metabolism and insulin sensitivity: a visual model of the pathogenesis of gestational diabetes mellitus [19]
BCAAs — Branched Chain Amino Acids; BCAT — Branched–Chain Aminotransferase; BCKD — Branched-Chain α-Keto Acid Dehydrogenase; A–CoA- alpha coenzyme A; TAC — total antioxidant capacity; КЦЖК — short-chain fatty acids; ЛПС — lipopolysaccharides; 1(PDK1) — 3-phosphoinositide-dependent protein kinase 1, 3-phosphoinositide-dependent protein kinase 1; ИЛ-12(10,14) — interleukins; ФНО — tumor necrosis factor, ИФН — interferon.
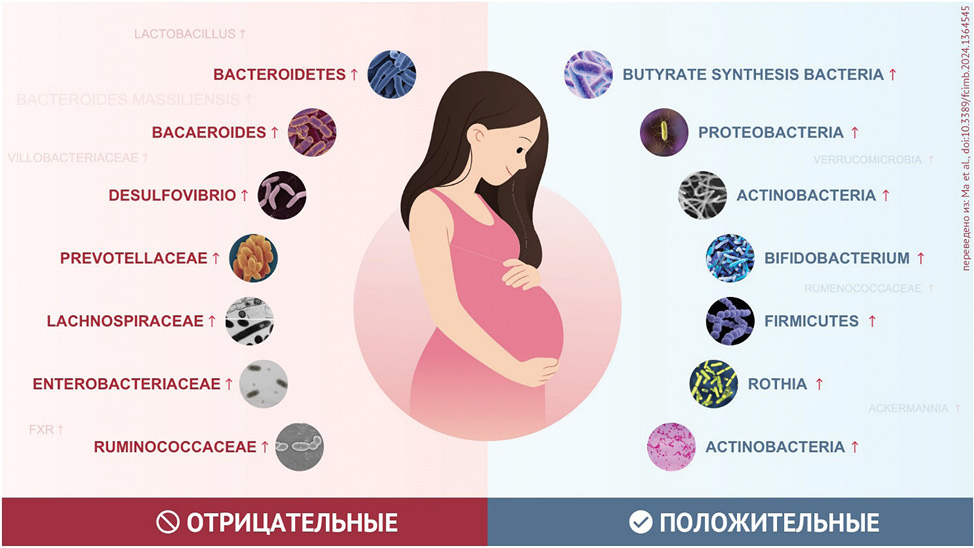
Рисунок 2. Роль кишечной микробиоты во время беременности [19]
Figure 2. The role of gut microbiota during pregnancy [19]
Обсуждение
Некоторые ограничения не позволяют нам судить о достижении четко определенной связи между ГСД и шаблоном изменений микробиома. Это отчасти связано с заметной неоднородностью проводимых исследований. Так, большинство исследований были из Китая и Финляндии, и в меньшей степени из некоторых других стран, что не позволяет нам обобщать результаты, особенно с учетом того, что известно о изменении микробиом под влиянием образа жизни различных генетических, экологических факторов,, которые различаются в разных регионах мира. Другая причина заключается в разнице критериев, используемых для диагностики ГСД, хотя диагноз в основном ставился в соответствии с критериями IADPSG (International Association of Diabetes and Pregnancy Study Groups, Международная ассоциация по изучению диабета и беременности). Различные критерии, используемые для диагностики ГСД, повлияли на сопоставимость результатов. Несмотря на то, что исследования в основном включали женщин с определенным ИМТ, возрастом, метаболическим статусом и исключали женщин с определенными хроническими заболеваниями или приемом лекарств, характеристики участников иногда различались в разных исследованиях, что могло повлиять на окончательные результаты. Это особенно касается использования антибиотиков, которые оставляют изменения состава микробиома, где период восстановления, необходимый после лечения антибиотиками, составляет не менее 1,5 месяцев, что было различным среди исследований, включенных в этот обзор [38]. Время, в которое анализировался микробиом, также различалось в разных статьях, особенно при оценке послеродового микробиома. Что касается использованного образца, источник образца иногда различался, особенно при оценке микробиома полости рта. Количество включенных участников также было неоднородным, где больший размер выборки относился к исследованиям, которые оценивали микробиом кишечника, в то время как меньшие исследования оценивали микробные сообщества в других трактах. Кроме того, метод микробного анализа и извлечения, праймеры ампликонов и методы секвенирования различались в разных исследованиях, что привело к неоднородным результатам.
Несмотря на эти ограничения, в исследованиях прослеживаются определенные корреляция между ГСД и микробиомом. Этот факт также рассматривался в предыдущих исследованиях, которые доказали наличие микробиоты, связанной с ГСД, и увеличение родов Collinsella spp. и Blautia spp. наблюдалось в случаях ГСД согласно Roldetal. [39][40]. Однако согласованности результатов не наблюдалось, и не удалось определить специфические для ГСД паттерны микробиома [40]. Разработка модулирующих подходов, нацеленных на микробиом, может повлиять на профилактику и предотвращение возможных последствий ГСД. Такие методы уже внедряются, например, использование пробиотиков и пребиотиков у женщин с ГСД и оценка их результатов для метаболического статуса, и на данный момент результаты кажутся многообещающими [1][41]. Вместе с тем, нам все еще нужно больше доказательств, и продолжающиеся исследования должны дополнительно рассмотреть этот результат в своих будущих исследованиях.
Заключение
ГСД и микробные сообщества организма находятся в тесной взаимосвязи. Известны определенные корреляции изменений микробиома в кишечнике, влагалище и ротовой полости беременных женщин в зависимости от ГСД. Дальнейший научный поиск в данном направлении является многообещающими и обнадеживающим в аспекте разработки стратегий, нацеленных на коррекцию микробиома человека с целью изучения новых терапевтических подходов для лечения или профилактики ГСД. Оценка результатов и эффективности таких терапевтических методов как использование пробиотиков и парабиотиков следующего поколения должна стать одним из важных направлений будущих исследований.
Список литературы
1. Hasain Z., Mokhtar N.M., Kamaruddin N.A., et al. Gut Microbiota and Gestational Diabetes Mellitus: A Review of Host-Gut Microbiota Interactions and Their Therapeutic Potential. Front Cell Infect Microbiol. 2020; 10:188. DOI: https://doi.org/10.3389/fcimb.2020.00188
2. Wang H., Li N., Chivese T., et al. IDF Diabetes Atlas: Estimation of Global and Regional Gestational Diabetes Mellitus Prevalence for 2021 by International Association of Diabetes in Pregnancy Study Group’s Criteria. Diabetes Res Clin Pract. 2022; 183:109050. DOI: https://doi.org/10.1016/j.diabres.2021.109050
3. Клинические рекомендации Гестационный сахарный диабет. Проект. 2024.
4. Бурумкулова Ф.Ф., Петрухин В.А. Гестационный сахарный диабет: вчера, сегодня, завтра. Терапевтический Архив. 2014; 86(10):109-115.
5. Hyperglycemia and Adverse Pregnancy Outcomes. N Engl J Med. 2008; 358(19): 1991-2002. DOI: https://doi.org/10.1056/nejmoa0707943
6. Чаплин А.В., Ребриков Д.В., Болдырева М.Н. Микробиом человека. Вестник РГМУ. 2017; (2): 5–13. DOI: https://doi.org/10.24075/brsmu.2017-02-01.
7. Зинина Т.А., Тиселько А.В., Ярмолинская М.И. Роль микробиоты кишечника в развитии осложнений у беременных с гестационным сахарным диабетом. Журнал акушерства и женских болезней. 2020; 69(4): 41-50. DOI: https://doi.org/10.17816/JOWD69441-50.
8. Yao Y., Cai X., Chen C., et al. The Role of Microbiomes in Pregnant Women and Offspring: Research Progress of Recent Years. Front Pharmacol. 2020; 11:643. DOI: https://doi.org/10.3389/fphar.2020.00643
9. Saad M.J., Santos A., Prada P.O. Linking Gut Microbiota and Inflammation to Obesity and Insulin Resistance. Physiology. 2016; 31(4): 283-293. DOI: https://doi.org/10.1152/physiol.00041.2015
10. Taddei C.R., Cortez R.V., Mattar R., Torloni M.R., Daher S. Microbiome in normal and pathological pregnancies: A literature overview. Am J Reprod Immunol. 2018; 80(2):e12993. DOI: https://doi.org/10.1111/aji.12993
11. Оноприйчук А.Р., Капустин Р.В., Аржанова О.Н. Роль микробиоты желудочно-кишечного тракта в развитии гестационного сахарного диабета. Акушерство и гинекология. 2020; 3: 18-24. DOI: https://doi.org/10.18565/aig.2020.3.18-24.
12. Moumne O., Hampe M.E., Montoya-Williams D., et al. Implications of the vaginal microbiome and potential restorative strategies on maternal health: a narrative review. J Perinat Med. 2021; 49(4):402-411. DOI: https://doi.org/10.1515/jpm-2020-0367
13. Jang H., Patoine A., Wu T.T., Castillo D.A., Xiao J. Oral microflora and pregnancy: a systematic review and meta-analysis. Sci Rep. 2021; 11(1):16870. DOI: https://doi.org/10.1038/s41598-021-96495-1
14. Dabke K., Hendrick G., Devkota S. The gut microbiome and metabolic syndrome. J Clin Invest. 2019; 129(10):4050- 4057. DOI: https://doi.org/10.1172/jci129194
15. Chen X., Devaraj S. Gut Microbiome in Obesity, Metabolic Syndrome, and Diabetes. Curr Diab Rep. 2018; 18(12):129. DOI: https://doi.org/10.1007/s11892-018-1104-3
16. Qin J., Li Y., Cai Z., et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012; 490(7418):55-60. DOI: https://doi.org/10.1038/nature11450
17. Kunasegaran T., Balasubramaniam V.R., Arasoo V.J., Palanisamy U.D., Ramadas A. The Modulation of Gut Microbiota Composition in the Pathophysiology of Gestational Diabetes Mellitus: A Systematic Review. Biology. 2021;10(10):1027. DOI: https://doi.org/10.3390/biology10101027
18. Neuman H., Koren O. The Pregnancy Microbiome. In: Isolauri E, Sherman PM, Walker WA, eds. Nestlé Nutrition Institute Workshop Series. Vol 88. S. Karger AG; 2017:1-10. DOI: https://doi.org/10.1159/000455207
19. Ma S., Wang Y., Ji X., et al. Relationship between gut microbiota and the pathogenesis of gestational diabetes mellitus: a systematic review. Front Cell Infect Microbiol. 2024; 14:1364545. DOI: https://doi.org/10.3389/fcimb.2024.1364545
20. Farhat S., Hemmatabadi M., Ejtahed H.S., Shirzad N., Larijani B. Microbiome alterations in women with gestational diabetes mellitus and their offspring: A systematic review. Front Endocrinol. 2022; 13:1060488. DOI: https://doi.org/10.3389/fendo.2022.1060488
21. De Siena M., Laterza L., Matteo M.V., et al. Gut and Reproductive Tract Microbiota Adaptation during Pregnancy: New Insights for Pregnancy-Related Complications and Therapy. Microorganisms. 2021; 9(3):473. DOI: https://doi.org/10.3390/microorganisms9030473
22. Юдина Ю.В., Корсунский А.А., Аминова А.И., Абдуллаева Г.Д., Продеус А.П. Микробиота кишечника как отдельная система организма. Доказательная гастроэнтерология. 2019; 8(4):36-43. DOI: https://doi.org/10.18705/1607-419X-2024-2359
23. Egshatyan L., Kashtanova D., Popenko A., et al. Gut microbiota and diet in patients with different glucose tolerance. Endocr Connect. 2016;5(1):1-9. DOI: https://doi.org/10.1530/ec-15-0094
24. Le Chatelier E., Nielsen T., Qin J, et al. Richness of human gut microbiome correlates with metabolic markers. Nature. 2013; 500(7464):541-546. DOI: https://doi.org/10.1038/nature12506
25. Rivière A., Selak M., Lantin D., Leroy F., De Vuyst L. Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Front Microbiol. 2016; 7. DOI: https://doi.org/10.3389/fmicb.2016.00979
26. Ottosson F., Brunkwall L., Ericson U., et al. Connection Between BMI-Related Plasma Metabolite Profile and Gut Microbiota. J Clin Endocrinol Metab. 2018; 103(4):1491- 1501. DOI: https://doi.org/10.1210/jc.2017-02114
27. Fugmann M., Breier M., Rottenkolber M., et al. The stool microbiota of insulin resistant women with recent gestational diabetes, a high risk group for type 2 diabetes. Sci Rep. 2015; 5(1):13212. DOI: https://doi.org/10.1038/srep13212
28. Koren O., Goodrich J.K., Cullender T.C., et al. Host Remodeling of the Gut Microbiome and Metabolic Changes during Pregnancy. Cell. 2012; 150(3):470-480. DOI: https://doi.org/10.1016/j.cell.2012.07.008
29. Cobb C., Kelly P., Williams K., Babbar S., Angolkar M., Derman R. The oral microbiome and adverse pregnancy outcomes. Int J Womens Health. 2017; Volume 9:551-559. DOI: https://doi.org/10.2147/ijwh.s142730
30. Zarco M., Vess T., Ginsburg G. The oral microbiome in health and disease and the potential impact on personalized dental medicine. Oral Dis. 2012; 18(2):109-120. DOI: https://doi.org/10.1111/j.1601-0825.2011.01851.x
31. Gao L., Xu T., Huang G., Jiang S., Gu Y., Chen F. Oral microbiomes: more and more importance in oral cavity and whole body. Protein Cell. 2018; 9(5):488-500. DOI: https://doi.org/10.1007/s13238-018-0548-1
32. He Z., Wu J., Xiao B., Xiao S., Li H., Wu K. The Initial Oral Microbiota of Neonates Among Subjects With Gestational Diabetes Mellitus. Front Pediatr. 2019;7:513. DOI: https://doi.org/10.3389/fped.2019.00513
33. Шипицына Е.В. Микробиом плаценты: сдвиг парадигмы или несовершенство методологии? Вестник Российской академии медицинских наук. 2021;76(5):436-448. DOI: https://doi.org/10.15690/vramn1489
34. Bassols J., Serino M., Carreras-Badosa G., et al. Gestational diabetes is associated with changes in placental microbiota and microbiome. Pediatr Res. 2016; 80(6):777-784. DOI: https://doi.org/10.1038/pr.2016.155
35. Tang N., Luo Z.C., Zhang L., et al. The Association Between Gestational Diabetes and Microbiota in Placenta and Cord Blood. Front Endocrinol. 2020; 11:550319. DOI: https://doi.org/10.3389/fendo.2020.550319
36. Stinson L.F., Payne M.S., Keelan J.A. Planting the seed: Origins, composition, and postnatal health significance of the fetal gastrointestinal microbiota. Crit Rev Microbiol. 2017; 43(3):352-369. DOI: https://doi.org/10.1080/1040841x.2016.1211088
37. Olomu I.N., Pena-Cortes L.C., Long R.A., et al. Elimination of “kitome” and “splashome” contamination results in lack of detection of a unique placental microbiome. BMC Microbiol. 2020; 20(1):157. DOI: https://doi.org/10.1186/s12866-020-01839-y
38. Palleja A., Mikkelsen K.H., Forslund S.K., et al. Recovery of gut microbiota of healthy adults following antibiotic exposure. Nat Microbiol. 2018; 3(11):1255-1265. DOI: https://doi.org/10.1038/s41564-018-0257-9
39. Medici Dualib P., Ogassavara J., Mattar R., Mariko Koga Da Silva E., Atala Dib S, De Almeida Pititto B. Gut microbiota and gestational Diabetes Mellitus: A systematic review. Diabetes Res Clin Pract. 2021; 180:109078. DOI: https://doi.org/10.1016/j.diabres.2021.109078
40. Rold L.S., Bundgaard-Nielsen C., Niemann Holm-Jacobsen J., et al. Characteristics of the gut microbiome in women with gestational diabetes mellitus: A systematic review. Chong CW, ed. PLOS ONE. 2022; 17(1):e0262618. DOI: https://doi.org/10.1371/journal.pone.0262618
41. Han M.M., Sun J.F., Su X.H., et al. Probiotics improve glucose and lipid metabolism in pregnant women: a meta-analysis. Ann Transl Med. 2019; 7(5):99-99. DOI: https://doi.org/10.21037/atm.2019.01.61.
Об авторах
О. В. ГайфуллинаРоссия
Гайфуллина Ольга Васыловна — ординатор
ул. Репина, д. 1, г. Екатеринбург, 620028
Е. Г. Дерябина
Россия
Дерябина Елена Геннадьевна — доктор медицинских наук, ведущий научный сотрудник отделения антенатальной охраны плода, врач-эндокринолог
ул. Репина, д. 1, г. Екатеринбург, 620028
ResearcherID: A-4758-2017
Scopus Author ID: 57191620146
О. А. Мелкозерова
Россия
Мелкозерова Оксана Александровна — доктор медицинских наук, доцент, заместитель директора института по науке
ул. Репина, д. 1, г. Екатеринбург, 620028
Телефон: +7 (343) 371 87 68
Рецензия
Для цитирования:
Гайфуллина О.В., Дерябина Е.Г., Мелкозерова О.А. Изменения микробиома у женщин с гестационным сахарным диабетом (обзор литературы). Вестник охраны материнства и младенчества. 2024;1(3):42-52. https://doi.org/10.69964/BMCC-2024-1-3-42-52
For citation:
Gaifullina O.V., Deryabina E.G., Melkozerova O.A. Microbiome alterations in women with gestational diabetes mellitus (literature review). Bulletin of maternal and child care. 2024;1(3):42-52. (In Russ.) https://doi.org/10.69964/BMCC-2024-1-3-42-52









